
| A. | 淀粉 | B. | KNO3溶液 | C. | 乙醇 | D. | 熔融的NaCl |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液后生成的沉淀一定是AgCl | |
| B. | 该混合液中-定含有:NH4+、CO32-、SO42-,可能含K+、Cl- | |
| C. | 该混合液中一定含有:NH4+、CO32-、SO42-、Cl-,可能含K+ | |
| D. | 该混合液中:c(K+)≥0.2mol/L c(CO32-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O的质量为18g•mol-1 | |
| B. | CO2的摩尔质量为44g | |
| C. | 1mol任何物质的质量等于该物质的相对分子质量 | |
| D. | H+的摩尔质量为1g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN溶液的导电性比盐酸的弱 | B. | 1mol/LNaCN溶液呈碱性 | ||
| C. | NaCN可以与盐酸反应 | D. | 1mol/LHCN溶液的pH约为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缺维生素A易患夜盲症 | B. | 缺铁易患白血病 | ||
| C. | 缺维生素C易患坏血病 | D. | 缺维生素D易患佝偻病 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
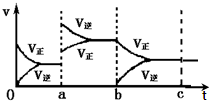 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com