
【题目】氧和硫的化合物在化工生产上应用非常广泛.试回答下列问题:
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。
己知:6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
则反应2O3(g)=3O2(g)的△H=___。
(2)SO2Cl2常用于制造医药品、染料、表面活性剂等.已知:SO2Cl2(g)![]() SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
SO2(g)+Cl2(g)△H=akJmol﹣1。300℃时向体积为2L的恒容密闭容器中充入0.20molSO2Cl2,达到平衡时,容器中含0.1molSO2,该温度时反应的平衡常数为___。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为___。
(3)对(2)中的反应,在400℃,1.01×105Pa条件下,向容积为2L的恒容密闭容器中充入一定量的SO2Cl2,n(SO2)和n(SO2Cl2)随时间的变化曲线如图所示。
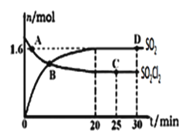
①0~20min反应的平均速率v(SO2Cl2)=___。△H___0(填“<”“>”或“=”)其原因是:___。
②下列叙述正确的是___。
A.A点v正(SO2Cl2)>v逆(SO2Cl2)
B.密度和平均摩尔质量不变均说明处于平衡状态
C.其它条件不变,若增大压强,n(SO2)比图中D点的值大
D.其它条件不变,500℃时反应达平衡,n(SO2)比图中D点的值大
【答案】﹣290kJ/mol 0.05mol/L 46.6g 0.04mol/(L.min) > 升高温度,平衡常数增大,所以正反应是吸热反应 AD
【解析】
(1)①6Ag(s)+O3(g)═3Ag2O(s);△H=﹣235kJ/mol;
②2Ag2O(s)═4Ag(s)+O2(g);△H=+60kJ/mol;
根据盖斯定律,①×2+②×3可得到2O3(g)=3O2(g),反应热![]() ;
;
(2)![]() ,
,![]() ,平衡常数
,平衡常数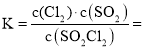
![]() ;根据S原子的守恒计算生成硫酸钡的质量,
;根据S原子的守恒计算生成硫酸钡的质量,![]()
![]() ;
;
(3)①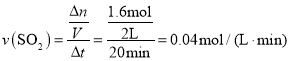 ,同一可逆反应中同一时间段内,各物质的反应速率之比等于其化学计量数之比,所以v(SO2Cl2)=v(
,同一可逆反应中同一时间段内,各物质的反应速率之比等于其化学计量数之比,所以v(SO2Cl2)=v(![]() )=
)=![]() ;由于升高温度,平衡常数增大,所以正反应是吸热反应;
;由于升高温度,平衡常数增大,所以正反应是吸热反应;
②A. A点平衡向正反应方向移动,说明正反应速率大于逆反应速率,A正确;
B. 因为反应前后质量不变,体积不变,所以密度一直不变,则密度不再改变不能说明反应达到平衡,B错误;
C. 增大压强,平衡向气体体积减小的方向移动,即向逆反应方向移动,所以![]() 减小,C错误;
减小,C错误;
D. 其他条件不变,升高温度,平衡正向移动,平衡时![]() 增大,所以
增大,所以![]() 比图中D大,D正确;
比图中D大,D正确;
故答案选AD。


科目:高中化学 来源: 题型:
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的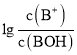 或
或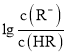 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()
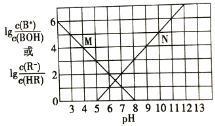
A.M线表示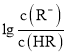 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:下列叙述正确的是
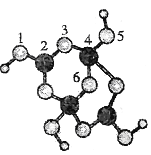
A.Xm-的化学式为B4O8H42-
B.硼原子轨道的杂化类型有sp2、 sp3
C.配位键存在于4、6原子之间
D.硼砂晶体中有离子键、配位键两种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_______________________。
(2)在容积为1L的密闭容器中,投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强变化如图1所示:
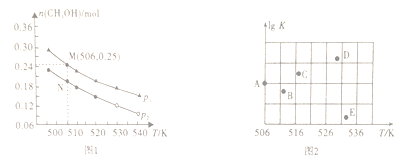
①该反应的△H_____0(填“>”、“<”或“=”),判断理由是_______________。
②M点时,CO的转化率为________。506K时该反应的平衡常数K=________(保留三位小数)。
③某同学绘制的压强为p时,不同温度下上述反应的平衡常数的对数值(lgK)如图2所示。A、B、C、D、E五点中能正确表示该反应的lgK与温度(T)的关系的点为____________。
④下列叙述能说明反应CO(g)+2H2(g) ![]() CH3OH(g)达到平衡状态的是________(填序号)。
CH3OH(g)达到平衡状态的是________(填序号)。
A.单位时间内生成2molH2的同时消耗1molCO
B.反应过程中c(CO):c(CH3OH)=1:1
C.恒温恒容时,混合气体的密度保持不变
D.绝热恒容时,反应的平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
A.X、W元素的离子半径 W<X
B.一定条件下,W单质可以与Z元素的氢化物发生化学反应
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li![]() LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A. 可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向负极移动.
C. 充电过程中,电池正极材料的质量减少
D. 放电时电池正极反应为:FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子排布式为_________________。钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是______________,VO43-的立体构型为__________。
(2)2-巯基烟酸氧钒配合物(图1)是副作用较小的有效调节血糖的新型药物。
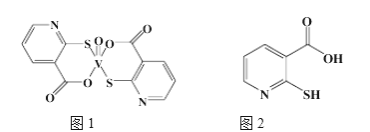
①该药物中N原子的杂化方式是____________,其所含第二周期元素第一电离能按由大到小顺序的排列是__________________。
②2-巯基烟酸(图2)水溶性优于2-疏基烟酸氧钒配合物的原因是_________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是________。
A.SO2 B.SO42- C.H2S D.CS2
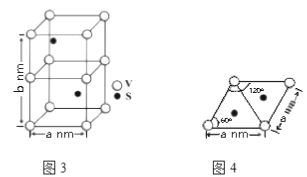
(4)某六方硫钒化合物晶体的晶胞如图3所示,图4为该晶胞的俯视图,该晶胞的密度为________________ g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com