
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子. | |
| B. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| C. | 溶于水后电离出氢离子的化合物都是酸 | |
| D. | 二氧化碳的水溶液能导电,故二氧化碳属于电解质 |
分析 A.氯化钠溶液中氯化钠在水分子作用下电离出阴阳离子;
B.强电解质指在水溶液中或熔融状态下,能完全电离;
C.溶于水后能电离出氢离子的化合物不一定是酸,如硫酸氢钠、亚硫酸氢钠等;
D.导电的离子不是二氧化碳电离的,二氧化碳为非电解质.
解答 解:A.氯化钠溶液中氯化钠在水分子作用下电离出阴阳离子,故A错误;
B.强电解质指在水溶液中或熔融状态下,能完全电离,硫酸钡属于强电解质,虽在水溶液中很难溶解,但溶于水的部分能完全电离,故B正确;
C.溶于水后电离出的阳离子全部是氢离子的是酸,故C错误;
D.二氧化碳的水溶液能导电,电离出阴阳离子的是碳酸,而不是二氧化碳,所以二氧化碳是非电解质,故D错误;
故选B.
点评 本题考查了酸的概念、电解质的电离、非电解质的判断等知识点,题目难度不大,注意明确电解质与弱电解质的区别,掌握酸的概念及判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
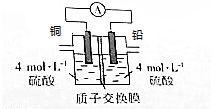 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅是非金属元素,它的单质是灰黑色有金属光泽的固体 | |
| D. | 加热到一定温度时硅能与H2、O2等非金属反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
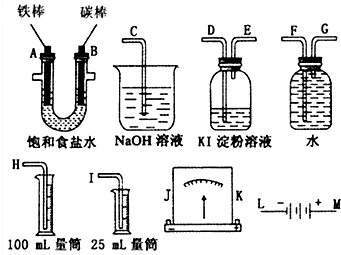 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com