
【题目】“长征二号”系列火箭用的燃料是液态的偏二甲肼(C2H8N2),氧化剂是液态的N2O4,已知已知1.5g偏二甲基肼完全燃烧生成N2、CO2和液态H2O放出热量50kJ热量。下列说法不正确的是
A. 燃料在火箭发动机中燃烧是将化学能主要转变为热能和机械能
B. 液态N2O4气化时共价键没被破坏
C. 依题可知C2H8N2的燃烧热为50kJ/mol
D. 偏二甲基肼在N2O4中燃烧时的化学方程式为:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O
2CO2+3N2+4H2O
科目:高中化学 来源: 题型:
【题目】(1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出配平的该反应的化学方程式:_______________
②被氧化的元素是___________
(2)氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它.CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+==Cu2++Cu.
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①写出CuH在氯气中燃烧的化学反应方程式:___________________________________.
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________.
(3)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组,用下列仪器、药品验证足量合金(由Cu、Fe、Zn三种物质组成)和适量浓硝酸反应产生的气体中含NO(N2和O2的用量可自由控制,气体液化温度:NO2:21℃,NO:-152℃)
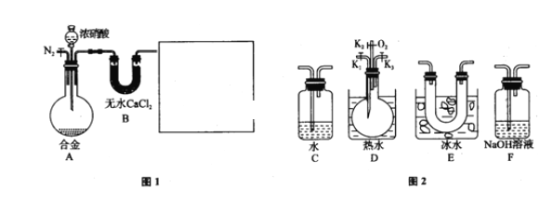
(1)在图2中选择恰当的仪器将图1补充完整,所选择仪器的连接顺序(按左→右连接,填各仪器编号)为_________.
(2)反应前先通入N2目的是_______________________________________.
(3)确认气体中含NO的现象是_____________________________________.
(4)本题中,浓硝酸(含溶质a mol)完全反应,还原产物只有NO和NO2,被还原硝酸的物质的量n的取值范围为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100℃时,水的离子积常数Kw=1×10-12,对于该温度下pH=l1的氨水,下列叙述正确的是
A. 向该溶液中加入同温同体积pH=1的盐酸,反应后溶液呈中性
B. 温度降低至25℃,该氨水溶液中H2O电离出的H+浓度小于10-11mol/L
C. 该氨水溶液中加入NH4Cl溶液,NH3·H2O的电离能力增强
D. 滴加等浓度等体积的硫酸,得到的溶液中存在电离平衡:NH4HSO4(aq)![]() NH4+(aq)+H+(aq)+SO42-(aq)
NH4+(aq)+H+(aq)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
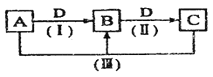
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:__________________________________(此反应的条件答题时不必写出)。B在工业上用于制备A,反应的化学方程式为:__________________________________。
(2)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)的化学方程式______________________________________________,其中氧化产物与还原产物的物质的量之比为______________。
(3)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①D的电子式为________________。
②写出反应(Ⅲ)的离子方程式:________________________________________________。
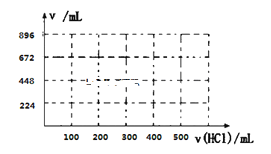
③取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L ,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为___________________________。请将产生气体的体积(标准状况下且不考虑产生气体在水中的溶解)随滴加盐酸的体积变化的曲线绘制在下图坐标系中。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
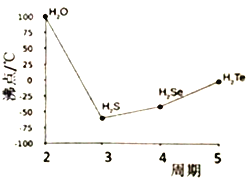
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氧化还原反应的叙述正确的是
A. 氧化还原反应的实质是有氧元素的得失
B. 氧化还原反应的实质是元素化合价的升降
C. 氧化还原反应的实质是电子的转移(得失或偏移)
D. 物质所含元素化合价升高的反应是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com