
工业上测量SO2.N2.O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2.O2不与I2反应):
![]() 。
。
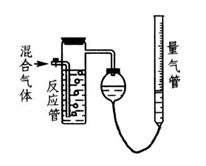
(1)混合气体进入反应管后,量气管内增加的水的体积等于____________的体积(填气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得SO2含量_______(填“偏高”.“偏低”.或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用______________代替(填写物质名称)。
(4)将上述装置改为简易实验装置,除导管外,还需选用的仪器为_______________(填仪器编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞
g.双孔塞
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修1 4.1改善大气质量练习卷(解析版) 题型:实验题
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。
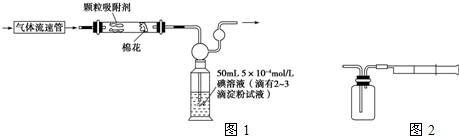
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定___________________________________________________
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100 mL 5×10-4 mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,___________________________
第二步:___________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用如图所示简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4 mol/L的碘溶液,注入图中所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为________次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:__________________、______________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_________________________。
查看答案和解析>>
科目:高中化学 来源:0102 月考题 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)为测定某地空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定_________________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助同学完成100 mL 5×10-4 mol·L-1碘溶液的配制:
第一步:准确称取1.27 g碘单质加入烧杯中,________________;
第二步:______________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4mol·L-1的碘溶液,注入上图所示广口瓶中,加2—3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,抽气次数至少为_____次,方可说明该地空气中排放的SO2含量符合标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_____________________________________________________________________。
③丙同学认为:乙同学的实验方案抽气次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_______________________________________。
(3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用______________(选填a.浓硫酸 b.银氨溶液 c.新制的氢氧化铜 d.酸化的高锰酸钾溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
空气中的SO2含量是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg/L。
 Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
Ⅰ:甲同学设计了如下图所示的实验装置,测定某地空气中SO2的含量:
(1)用上述装置测定空气中的SO2含量依据的化学反应原理是:
▲ (用化学方程式表示)。
(2)应用上述装置测定空气中的SO2含量,除测定气体流速(单位:cm3/min)外,还需要测定的数据是 ▲ 。
 Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
Ⅱ:乙同学拟用如右图简易装置测定空气中的SO2含量:准确移取一定体积的5×10-4mol/L的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
(3)若乙同学在实验室配制100 mL 5×10-4mol/L的碘溶液,需要用到的玻璃仪器是
▲ 。
(4) 如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,你认为其中可能的原因(假设溶液配制、称量或量取及各种读数均无误)是:
▲ 。
Ⅲ:SO2的排放是造成酸雨的主要因素,丙同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,丙同学取某一时段的这种雨水V L,加入0.5mol·L-1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
(5)该V L雨水中溶解SO2的体积是 ▲ mL(标准状况)。
(6)若生成沉淀物的质量为4.50 g,该雨水中含有H2SO3的物质的量浓度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com