
【题目】下列过程是非自发的是
A.水由高处向低处流 B.煤炭的燃烧 C.铁在潮湿空气中生锈 D.室温下水结成冰
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作食品、牙粉、化妆品的添加剂,也可用作种子的消毒剂。已知从溶液中制备的过氧化钙带有8个结晶水,在100℃时会脱水生成米黄色的无水过氧化钙,而无水过氧化钙在350℃时会迅速分解生成CaO和O2。回答下列问题:
①CaO2中含有的化学键类型是________________。
(2)实验室用纯净的CaCO3与H2O2制取过氧化钙的实验步骤如下:

①烧杯A中发生反应的离子方程式为_____________________ 。
②过滤时用到的玻璃仪器除烧杯外,还有______________________。
③用冰水冷却烧杯C的目的是___________________。
(3)为测定产品中CaO2的质量分数,取m g样品,在温度高于350℃时使之充分分解,并将产生的气体(恢复至标准状况)通过下图所示装置,收集到水的体积为V mL,则产品CaO2的质量分数为__________(列出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+2B(g)===3C(g)+4D(g)中,表示该反应速率最快的是
A. v(A)=0.2 mol/(L·s) B. v(B)=0.6 mol/(L·s)
C. v(C)=0.8 mol/(L·s) D. v(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1=578 kJ/mol; I2= l817 kJ/mol; I3=2745 kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2的结构式是__________是__________(填“极性分子”或“非极性分子”),1mol该分子中存在________个σ键。

(2)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的电负性由大到小的顺序为_________(用元素符号作答)。
(3)已知Z的晶胞结构如图所示,又知Z的密度为a g/cm3,则Z 的半径为___________pm;ZYO4常作电镀液,其中YO42-的等电子体是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是___________。
A.O2是氧化剂 B.HO2是氧化产物
C.HO2在碱中能稳定存在 D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.两个原子间形成的共价键键能越大,键长越短,键越牢固
B.两个原子半径之和就是所形成的共价键键长
C.两个原子间键长越长,键越牢固
D.键的强度与键长无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)相同条件下,某容器共收集到1体积CO2、3体积H2 , 该容器中CO2、H2的物质的量之比是;若该容器收集的CO2、H2两种气体所含分子数相等,则CO2、H2的质量之比是 .
(2)44g M和49g N恰好完全反应生成76g B和一定量的气体F.若F的相对分子质量为34,则标准状况下F的体积为 .
(3)已知A是二价金属,82g该金属的硝酸盐中含有6.02×1023个硝酸根离子,则该硝酸盐的摩尔质量为 .
(4)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质转化关系的说法中不正确的是( )

A. 图1中甲可能是Cl2,X可能是Fe
B. 图2中反应一定是置换反应或复分解反应
C. 图3中是向某溶液中滴加NaOH溶液的变化图像,原溶质可能是Al2(SO4)3
D. 图4中a可能为NaOH,b可能为Na2CO3,c可能为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某校研究性学习小组的同学拟制备一氯化碘。回答下列问题:
(1)甲组同学拟利用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
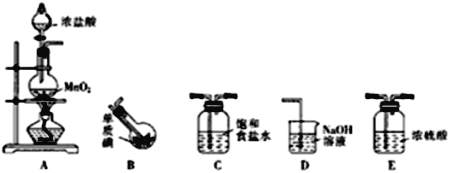
①各装置连接顺序为A→_________________;A装置中发生反应的离子方程式为_____________________________。
②B装置烧瓶需放在冷水中,其目的是_____________________,D装置的作用是_________________。
③将B装置得到的液态产物进一提纯可得到较纯净的ICl,则提纯采取的操作方法是______________。
(2)乙组同学采用的是最新报道的制一氯化碘的方法。即在三颈烧瓶中加入粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘。则发生反应的化学方程式为_______________________________。
(3)设计实验证明:
①ICl的氧化性比I2强:__________________________。
②ICl与乙烯作用发生加成反应:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:H2(g)+ Cl2(g) ═ 2HCl(g) △H=-184.6 kJmol-1则反应HCl(g) ═1/2 H2(g) +1/2 Cl2(g)的△H为_______。
(2)由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是_______kJ/mol。
(3)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为_______kJ/mol
(4)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com