
�й����ʼ�����ͼ��ʾ��ת����ϵ����֪B��D��G�dz����Ľ������ʣ�EΪ�����ǽ������ʣ�H������Ϊ��ɫҺ�壬KΪ����ɫ���塣
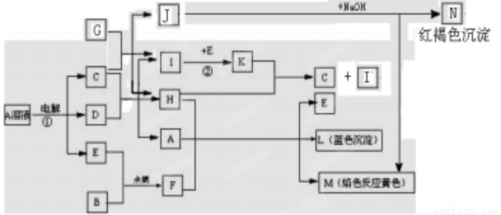
��1��F�ĵ���ʽ_____________,д������CO2��Ӧ�Ļ�ѧ����ʽ����˫���ű������ת�Ƶķ������Ŀ_____________________________________
��2����Ӧ�ٵ����ӷ���ʽ_________________________________________��
��3��C������G��Ӧ�Ļ�ѧ����ʽ_______________________________,���У���ԭ���������������ʵ���֮��______________________,���鷴Ӧ�����ɽ������ӵķ���ʽ__________________________________
��4��Al����A�����û���Ӧ��������������Na2CO3��������Һ�й��棬�����ӷ���ʽ��ʾ��ԭ��___________________________
��5��I����ij���⻯��������õ����仯ѧ��Ӧ����ʽΪ________________________
��6��Ư��ͬF��Ӧ�ܷⱣ�棬д��Ư��¶���ڿ�����ʧЧ�Ļ�ѧ��Ӧ����ʽ______________________��__________________________________��
��1��
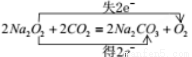
��2��2Cu2����2H2O 2Cu��O2����4H��
2Cu��O2����4H��
��3��3Fe��8HNO3(ϡ)=3Fe(NO3)2��2NO����4H2O 3:2 �� 3Fe2����2[Fe(CN)6]3��=Fe3[Fe(CN)6]2����
��4��2Al3����3CO32����3H2O=2Al(OH)3����3CO2�� ����5��4NH3��5O2 4NO��6H2O��
4NO��6H2O��
��6�� Ca(ClO)2��CO2��H2O=CaCO3��2HClO 2HClO2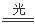 HCl��O2��
HCl��O2��
��������
������������������֪��A��Cu(NO3)2��D��Cu��E��O2��C��HNO3��G��Fe��J��Fe(NO3)2��Cu��ϡ���ᷢ����Ӧ������H��H2O��I��NO��K��NO2�� F��Na2O2��B��Na��F��Na2O2��M����������Һ��L��Cu(OH)2������N��Fe(OH)3��������1��F Na2O2�ĵ���ʽ�����ʽ�ǣ� ������CO2��Ӧ�ķ���ʽ��˫���ŷ���ʾ�ǣ�
������CO2��Ӧ�ķ���ʽ��˫���ŷ���ʾ�ǣ�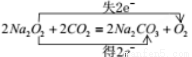 ����2������Cu2+>H+������������Cu2+�ŵ磻�������ӷŵ�������OH->NO3-����������������OH-�ŵ硣���Է�Ӧ�ٵ����ӷ���ʽ��2Cu2����2H2O
����2������Cu2+>H+������������Cu2+�ŵ磻�������ӷŵ�������OH->NO3-����������������OH-�ŵ硣���Է�Ӧ�ٵ����ӷ���ʽ��2Cu2����2H2O 2Cu��O2����4H������3��C������Fe��Ӧʱ��Fe������ΪFe2+�����ᱻ��ԭΪNO����Ӧ�Ļ�ѧ����ʽ��3Fe��8HNO3(ϡ)=3Fe(NO3)2��2NO����4H2O �����У���ԭ��Fe��������HNO3�����ʵ���֮����3:2�����鷴Ӧ�����ɽ�������Fe2+�ķ����Ǽ���[Fe(CN)6]3����������ɫ��������Ӧ�����ӷ���ʽ��3Fe2����2[Fe(CN)6]3��=Fe3[Fe(CN)6]2������4��Al����A�����û���Ӧ��������Al(NO3)3��Na2CO3����Һ�лᷢ��˫ˮ�ⷴӦ������������������������̼�������������Һ�й��棬�����ӷ���ʽ��ʾ��2Al3����3CO32����3H2O=2Al(OH)3����3CO2������5��I����ij���⻯��NH3�������õ����仯ѧ��Ӧ����ʽΪ4NH3��5O2
2Cu��O2����4H������3��C������Fe��Ӧʱ��Fe������ΪFe2+�����ᱻ��ԭΪNO����Ӧ�Ļ�ѧ����ʽ��3Fe��8HNO3(ϡ)=3Fe(NO3)2��2NO����4H2O �����У���ԭ��Fe��������HNO3�����ʵ���֮����3:2�����鷴Ӧ�����ɽ�������Fe2+�ķ����Ǽ���[Fe(CN)6]3����������ɫ��������Ӧ�����ӷ���ʽ��3Fe2����2[Fe(CN)6]3��=Fe3[Fe(CN)6]2������4��Al����A�����û���Ӧ��������Al(NO3)3��Na2CO3����Һ�лᷢ��˫ˮ�ⷴӦ������������������������̼�������������Һ�й��棬�����ӷ���ʽ��ʾ��2Al3����3CO32����3H2O=2Al(OH)3����3CO2������5��I����ij���⻯��NH3�������õ����仯ѧ��Ӧ����ʽΪ4NH3��5O2 4NO��6H2O; ��6��Ư��ͬF��Ӧ�ܷⱣ�棬����Ư��¶���ڿ�����ʧЧ����Ӧ�Ļ�ѧ��Ӧ����ʽ�ǣ�Ca(ClO)2��CO2��H2O=CaCO3��2HClO �� 2HClO2
4NO��6H2O; ��6��Ư��ͬF��Ӧ�ܷⱣ�棬����Ư��¶���ڿ�����ʧЧ����Ӧ�Ļ�ѧ��Ӧ����ʽ�ǣ�Ca(ClO)2��CO2��H2O=CaCO3��2HClO �� 2HClO2 HCl��O2����
HCl��O2����
���㣺�������ʵ��ƶϡ���ⷽ��ʽ�����ӷ���ʽ����ѧ����ʽ����д���ε�ˮ�⡢���ӵļ����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�찲��ʡ����ʮУ����11��������ѧ�Ծ��������棩 ���ͣ������
��17�֣�Na��Cu��Al��O��C��H�dz���������Ԫ�ء�
��1��Alλ��Ԫ�����ڱ���_____���ڵ�_____�壻Cu�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��
��2���á�����������գ�
��һ������ | ���Ӱ뾶 | �е� |
Na_______Al | O2��_______Na+ | CH4______H2O |
��3��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g)  2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
�� �� | CH4 | CO2 | CO | H2 |
������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=__________
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H= 890.3 kJ��mol��1
890.3 kJ��mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H=+2.8 kJ��mol��1
2CO(g)��O2(g)��2CO2(g) ��H= 566.0 kJ��mol��1
566.0 kJ��mol��1
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H=________________
2CO(g)��2H2(g) �ġ�H=________________
��4���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________________.
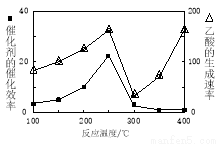
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________________
��5�����ø��µ�⼼���ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��Ӧ����ʽΪ�� ���乤��ԭ��ʾ��ͼ���£�
���乤��ԭ��ʾ��ͼ���£�
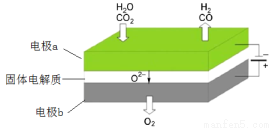
CO2�ڵ缫a�ŵ�ķ�Ӧʽ��_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����������и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij����ѧϰС�����۱�������˵����������ȷ����
�ٴ��κ����궼�ǻ���� ��������ˮú�����ǿ�������Դ
�۱��ɱ����Ǵ��������ǻ����� �ܲ���ֺ�Ŀǰ��ͨ��Ӳ�Ҷ��ǺϽ�
�ݴ������ʯ�Ҷ��Ǽ� �����������ǽ���
A���٢ۢܢ� B���٢ڢݢ� C���ۢݢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�����п��������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
������ˮ��Һ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ�������ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ���һ�֡��������ѧ��ѧ֪ʶ�ش��������⣺
��1�������Ƕ�Ԫ���ᣬ���������Һ�����ԡ���O.1mol��L��1 KHC2O4��Һ�У����й�ϵ��ȷ����____________
A��c(K+)+c(H+) = c(HC2O4��)+c(OH��)+c(C2O42��)
B��c(HC2O4��)+c(C2O42��) = 0.1 mol��L��1
C��c(C2O42��) < c(H2C2O4)
D��c(K+) = c(H2C2O4)+c(HC2O4��)+c(C2O42��)
��2��0.1 mol��L��1��NaHCO3��Һ�д��ڵ�ƽ����(�����ӷ���ʽ��ʾ)_____________��
��3��MOH��ROH����һԪ�����Һ�ֱ��ˮϡ��ʱ��pH�仯����ͼ��ʾ�����������в���ȷ����
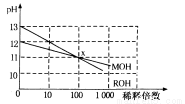
A��ROH��һ��ǿ��
B����x�㣬MOHδ��ȫ����
C����x�㣬c(M��)��c(R��)
D��ϡ��ǰ��c(ROH)��10c(MOH)
��4��AgCl����Һ�д�������ƽ�⣺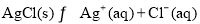 ��25��ʱ��AgCl��
��25��ʱ��AgCl��
Ksp��1.8��10��10���ֽ�����AgCl�ֱ��������Һ���У���100 mL����ˮ ��100 mL 0.3
mol��L��1 AgNO3��Һ ��100 mL 0.1 mol��L��1MgCl2��Һ��ֽ������ȴ����ͬ�¶ȣ�Ag��
Ũ���ɴ�С��˳��Ϊ_____________(�����)����50 mL 0.018 mol/L��AgNO3��Һ�м�
��50 mL 0.02 mol/L�����ᣬ�������ɺ���Һ��c(Ag��)��________mol/L����������ɳ���
�����Һ���ټ���50 mL 0.001 mol/L�����ᣬ�Ƿ��������_______(��ǡ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ĸ�����ѧ�����п��������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���Խ���ӦZn+Br2 = ZnBr2��Ƴ����أ�����4���缫��Ӧ
��Br2 + 2e�� = 2Br- ��2Br- - 2e�� = Br2 ��Zn �C 2e�� = Zn2+ ��Zn2+ + 2e�� = Zn���б�ʾ���ʱ��������Ӧ�ͷŵ�ʱ�ĸ�����Ӧ�ķֱ���
A���ں͢� B���ں͢� C���ۺ͢� D���ܺ͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������������;�������д�����ǣ���
A��������Fe2(SO4)3������������ˮ��
B������ʳ�ؽ����εIJ��˺���ţ���Խⶾ
C����ȥ���������۹�����ѡ�����ռ���Һ
D����FeCl3��Һ�еμӹ�����ˮ������ȡFe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����һ�и�����ѧ9�¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�Ԫ�ػ������˵����ȷ���ǣ���
A�������£�1molͭƬͶ�뺬��4mol HNO3��Ũ�����У�ͭƬ������ȫ�ܽ�
B��Al��Sֱ�ӻ��Ͽ��Եõ�Al2S3,Fe��Sֱ�ӻ���Ҳ���Եõ�Fe2S3
C�����AlCl3��FeCl3��CuCl2�Ļ����Һ�У���������������Cu��Fe��Al
D����Ӧ14CuSO4��5FeS2��12H2O=7Cu2S+5FeSO4��12H2SO4,FeS2�е���Ԫ��ȫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ2015�����9�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��16�֣�ijͬѧΪ����֤Fe3+�Ƿ�������H2SO3������SO42�C������50mL0.1mol/LFeCl3��Һ������ȡSO2�����β�����ٽ�������ʵ�飺
��1����������Һ�е�SO42�C�� ����֤��Fe3+�ܰ�H2SO3����ΪSO42�C��
��2������ƽ�����������Ӧ�еĻ�ѧ����ʽ��
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl����Ӧ�е����������� ��д��ѧʽ����
��3������Һ�г��˺���H+��Cl�C��SO42�C���⣬�������ɷݣ�Fe3+��Fe2+��H2SO3���Ŀ�����Ͻ���̽����
��������衣
����1����Һ�д���Fe3+��Fe2+��
����2����Һ�д��� ��
����3����Һ�д���Fe2+ ��������H2SO3 ������ǡ����ȫ��Ӧ����
����Ʒ���������ʵ�飬��֤���衣���ڱ���д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ����Բ�����������ѡʵ���Լ����������Թܡ��ιܡ�0.1moL L-1KMnO4��0.1moL
L-1KMnO4��0.1moL L-1KSCN��Һ��Ʒ��ϡ��Һ��
L-1KSCN��Һ��Ʒ��ϡ��Һ��
ʵ�鲽�� | Ԥ������ͽ��� |
����1�����Թ�ȡ��Ʒ��Һ2~3mL�����õι�ȡ | ������Ѫ��ɫ�������1��������δ����Ѫ��ɫ�������2�����3������ |
����2��
| ��ϲ���1������ͽ��ۣ�
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����һ�ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ������˵���У�����ȷ����
A�� ������ͨ�õ�ѭ��������־����ƻ��ձ�־
������ͨ�õ�ѭ��������־����ƻ��ձ�־
B��������������ϩ��������ϩһ���Գ������������ճ�����
C��75%���Ҵ���Һ����������������Ϊ�ƾ��ܹ�ʹϸ�������ʷ�������
D��ҳ�����Ǵ�ҳ�Ҳ��п��ɳ�������Ȼ�������ڲ�����ҳ�ҷֲ��㡢��ȴ����ձ麬�����ʿ��Գ�Ϊ�µĻ�ʯȼ����Դ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com