
【题目】下列溶液或浊液中,关于离子浓度的说法正确的是
A. 一定浓度的氨水加水稀释的过程中,c(NH4+)/ c(NH3·H2O)的比值减小
B. 浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中:c(CO32-)< c(HCO3-),且3c(Na+)=2[c(CO32-)+c(HCO3-+ c(H2CO3)]
C. 0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后:c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+)
D. 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
【答案】C
【解析】
试题A、一定浓度的氨水加水稀释的过程中,氢氧根浓度减小,根据电离常数可知c(NH4+)/ c(NH3·H2O)=![]() ,温度不变,电离常数不变,氢氧根浓度减小,则比值增大,A错误; B、浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中碳酸根的水解程度大于碳酸氢根,则c(CO32-)<c(HCO3-),由于不能确定二者的体积,则3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]是错误的,B不正确;C、0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后醋酸过量,根据电荷守恒c(CH3COO-) +c(OH-) = c(Na+) + c(H+)和物料守恒c(CH3COO-) +c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+),C正确;D、常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,当Ag2CrO4悬浊液中的c(Ag+)不一定小于AgCl悬浊液中的c(Ag+),还需要考虑阴离子的浓度,D错误,故选C。
,温度不变,电离常数不变,氢氧根浓度减小,则比值增大,A错误; B、浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液中碳酸根的水解程度大于碳酸氢根,则c(CO32-)<c(HCO3-),由于不能确定二者的体积,则3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]是错误的,B不正确;C、0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1 NaOH溶液等体积混合后醋酸过量,根据电荷守恒c(CH3COO-) +c(OH-) = c(Na+) + c(H+)和物料守恒c(CH3COO-) +c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-) + 2c(OH-)=c(CH3COOH) + 2c(H+),C正确;D、常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,当Ag2CrO4悬浊液中的c(Ag+)不一定小于AgCl悬浊液中的c(Ag+),还需要考虑阴离子的浓度,D错误,故选C。


科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
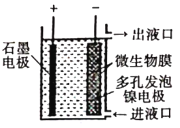
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校同学设计下列实验,探究CaS脱除烟气中的SO2并回收S。实验步骤如下:
步骤1.称取一定量的CaS放入三口烧瓶中并加入甲醇作溶剂(如下图所示)。
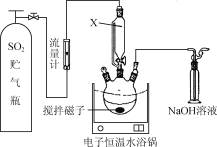
步骤2.向CaS的甲醇悬浊液中缓缓通入一定量的SO2。
步骤3.过滤,得滤液和滤渣。
步骤4.从滤液中回收甲醇(沸点为64.7 ℃),所得残渣与步骤3的滤渣合并。
步骤5.用CS2从滤渣中萃取回收单质S。
(1) 图中用仪器X代替普通分液漏斗的突出优点是________________。
(2) 三口烧瓶中生成硫和亚硫酸钙的化学方程式为________________,三口烧瓶中最后残留固体中含一定量的CaSO4,其原因是________________。
(3) 步骤4“回收甲醇”需进行的操作方法是________________。
(4) 步骤5为使滤渣中S尽可能被萃取,可采取的操作方案是________________。
(5) 请设计从上述回收的S和得到的含Na2SO3吸收液制备Na2S2O3·5H2O的实验方案:
称取稍过量硫粉放入烧杯中,__________________________________________,用滤纸吸干。
已知:① 在液体沸腾状态下,可发生反应Na2SO3+S+5H2O![]() Na2S2O3·5H2O。
Na2S2O3·5H2O。
②硫不溶于Na2SO3溶液,微溶于乙醇。
③为获得纯净产品,需要进行脱色处理。
④须使用的试剂:S、Na2SO3吸收液、乙醇、活性炭。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如图实验方案和实验装置。(已知SO2能与酸性KMnO4反应生成硫酸盐)

I.探究该合金的某些性质:
(1)取ag合金粉末放入蒸馏烧瓶,并加入足量浓H2SO4,A、B中均无明显现象,原因是__;
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出此时合金中成分碳参与的化学反应方程式__;
(3)装置D的作用是__;装置E的作用是__。
II.测定样品中碳的质量分数:
(4)装置F的作用__;
(5)若反应前后E装置的质量分别是m1和m2,则合金中碳的质量分数是__,若没有连接D装置会使测定结果__(填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一元弱酸HA的电离平衡常数K =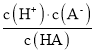 。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
化学式 | CH3COOH | HCN | H2CO3 |
K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
下列说法正确的是
A. 稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小
B. NaHCO3溶液中:c(H2CO3) < c(![]() ) < c(HCO3)
) < c(HCO3)
C. 25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液
D. 向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
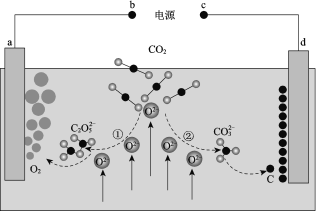
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

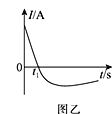
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2C12)是有机合成领域常用的氯化剂、磺化剂、氯磺化剂,熔点-54.1℃,沸点69.1℃,在潮湿空气中会产生酸雾,高温下容易分解。某化学小组用下图所示装置制取磺酰氯,反应原理是:SO2(g)+C12(g)=SO2C12 (1)△H=-97.3kJ/mol,请回答相关问题。

(1)仪器组装好以后首先要进行的操作是____。
(2)装置E的仪器名称是___,所装药品是____。
(3)若缺少装置B,三颈烧瓶中会发生的主要副反应化学方程式是____(任写一个)。装置B更换为某装置后可起到同样的作用,该装置可以是____。
(4)通过气体流量计测得通入Cl2的体积折合成标准状况为3.36L(SO2足量),最终得到的SO2C12质量为8.1g,则产率___。下列措施能提高SO2C12产率的是___。(填选项序号)
a.加快通入氯气的速率
b.三颈烧瓶温度过高时适当冷却
c.先打开分液漏斗活塞并通入氯气再通入冷凝水
(5)某同学在实验过程中不小心将SO2C12与H2SO4混合在一起,分离该混合物的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com