
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol・L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。如何判断滴定终点
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
科目:高中化学 来源: 题型:
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03﹣、OH﹣、I﹣中的几种,并且水 电离出的c(H+)=1×lO﹣13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是( )
|
| A. | 溶液的pH=1或13 | B. | 溶液中一定没有Fe3+,Na+ |
|
| C. | 溶液中阴离子有I﹣,不能确定HCO3﹣ | D. | 当Cl2过量,所得溶液只含有两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不正确的是 _。
A.在催化剂存在的条件下, 苯和溴水发生反应可生成无色、比水重的液体溴苯
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是 ( )
A.反应①的平衡常数K1=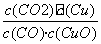
B.反应③的平衡常数K=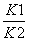
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④pH=11的NaOH溶液
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,则下列说法不正确的是( )
A. 1mol氯气参加氧化还原反应时电子转移2NA
B. 3.2gSO2与2.3gNO2所含有的氧原子数相等
C. 1molNa2O2与足量水反应后转移的电子数为NA
D. 1L0.1mol/LMgCl2溶液中Cl—离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A. 久置的氯水与新制的氯水,都能使有色布条褪色
B. 氯气、液氯和氯水是同一种物质
C. 碘化钾溶液中加淀粉溶液变蓝色
D. 加碘盐就是在食盐中加入适量的碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
物A是链状化合物,分子内只含有两种官能团,A和一些化学试剂的反应情况如下图所示:
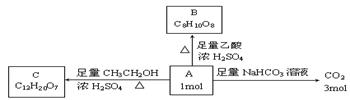
请回答下列问题:
(1)A分子内含有的两种官能团是(写名称) 。
(2)核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 。
(3)由A生成B的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为_______________________________________;
(2)Mn基态原子核外处在能量最高的能级上的电子共有________种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为_________________________________;
② HCHO分子中C原子轨道的杂化类型为___________________________________;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH) 4]2-的结构可用示意图表示为______________________________;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是________________________g(保留两位小数);阿伏加德罗常数为_____________________________________(列式计算,保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com