
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS)。羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。反应方程式为:
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
①羰基硫的电子式为_________其含有的共价键类型是________共价键。
②下列能说明碳与硫两元素非金属性相对强弱的是_____________。
a.相同条件下水溶液的pH:Na2CO3 > Na2SO4
b.酸性:H2SO3 > H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式__________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
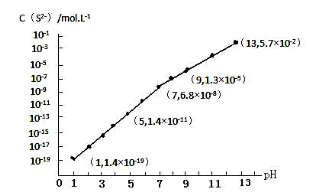
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
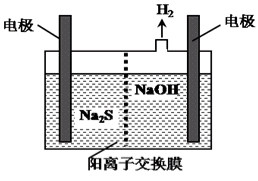
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:______________________。
②Na2S溶液中离子浓度由大到小顺序:________________________。
【答案】(1)①![]() ;极性(各1分,其余均为2分);②ac
;极性(各1分,其余均为2分);②ac
(2)5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O
(3)①0.043;②5
(4)①2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②c(Na+)>c(S2-)>c(OH-)>c(HS-)>C(H+)
【解析】
试题分析:(1)①羰基硫与二氧化碳是等电子体,其结构相似,根据二氧化碳电子式书写羰基硫电子式为![]() ;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为:
;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为:![]() ;极性;
;极性;
②a.相同条件下水溶液的pH:NaHCO3 > NaHSO4,可知硫酸酸性大于碳酸,则非金属性S > C,故选;b.亚硫酸不是最高价含氧酸,则酸性:H2SO3 > H2CO3,不能比较非金属性,故不选;c.S与H2的化合比C与H2的化合更容易,则非金属性S > C,故选;故答案为:ac;
(2)该反应中S元素化合价由-2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10molL-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10molL-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=![]() =
=![]() mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,故答案为:5;
mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,故答案为:5;
(4)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②硫离子存在两步水解,且第一步水解程度远远大于第二步,两步水解都生成OH-,溶液呈碱性,溶液中氢离子浓度很小,所以离子浓度大小顺序是c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+),故答案为:c(Na+) > c(S2-) > c(OH-) > c(HS-) > c(H+)。


科目:高中化学 来源: 题型:
【题目】如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
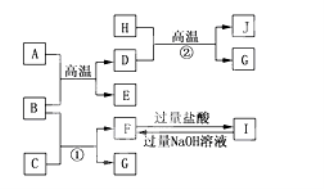
根据图示回答问题:
(1)写出下列物质的化学式: C ,E ,I ,J 。
(2)反应①的离子方程式是_____________________;反应②的化学方程式是________________________;
(3)F与I反应的离子方程式是__________________;
(4)向一定体积的稀硫酸中加入少量的J固体,反应后的溶液与NaClO发生氧化还原反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是__ (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A、二氧化硅用于制备太阳能电池板
B、氯气可用于自来水杀菌消毒
C、从海水中提取物质不一定必须通过化学反应才能实现
D、氢氟酸不能保存在玻璃瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图为![]() ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为 ,其气态氢化物的化学式为
(2)D在周期表的 周期, 族。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用元素符号填写)
(4)B的最高价氧化物的水化物的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系不正确的是
A. 热稳定性:HCl>HI
B. O2和O3互为同素异形体
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
D. 干冰和冰为同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.NH3的喷泉实验说明氨气极易溶于水
B.NO 和NH3均可用排空气法收集
C.盛液溴的瓶内加少量水可防止液溴的挥发
D.NH3遇到挥发性的强酸能冒白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题
Ⅰ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:
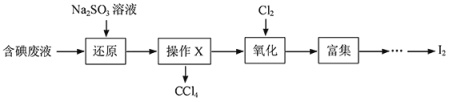
(1)Na2SO3溶液在空气中存放,容易被氧化成 (填化学式)。
检验是否存在该杂质的方法是: 。
(2)操作X的名称为 。
(3)通入Cl2发生反应的离子方程式 。
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是 。
Ⅱ.亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):
Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O。回答下列问题:
(1)若反应中有5 mole- 转移,则生成碘是 mol。
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO―+SO42-(快)
③IO―+SO32-→I―+SO42-(快)
④5I―+6H++IO3-→3I2+3H2O(快)
⑤I2+SO32-+H2O→2I-+SO42-+2H2(快)
由上述条件推测,此反应的总的反应速率由第 步反应决定(填序号)。
(3)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,蓝色现象才会产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com