
| A. | 氯碱工业 | B. | 从海水中提取镁 | C. | 高炉炼铁 | D. | 侯德榜制碱 |
分析 发生的化学反应中,若存在元素的化合价变化,则属于氧化还原反应,以此来解答.
解答 解:A.氯碱工业中电解食盐水生成氢气、氯气,H、Cl元素的化合价变化,为氧化还原反应,故A不选;
B.从海水中提取镁,电解熔融的MgO时,存在元素的化合价变化,为氧化还原反应,故B不选;
C.高炉炼铁中铁元素由化合态转化为游离态,存在元素的化合价变化,为氧化还原反应,故C不选;
D.侯德榜制碱中,二氧化碳、氨气、氯化钠反应生成碳酸钠和氯化铵,没有元素的化合价变化,则不涉及氧化还原反应,故D选;
故选D.
点评 本题考查氧化还原反应,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从元素化合价变化角度分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 分子式分别为C2H4和C4H8的两种有机物一定是同系物 | |
| B. | 同一种分子式可能代表不止一种物质 | |
| C. | 苯的产量是石化工业发展水平的标志 | |
| D. | 烷烃的通式是:CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L0.6mol•L-1的食盐水中含氯化钠0.6mol | |
| B. | 0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2mol•L-1 | |
| D. | 20g氢氧化钠溶于水配成物质的量浓度为1mol•L-1的溶液,可得溶液1L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
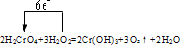
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 使用青霉素时,不用进行试验直接静脉注射 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 对于标记“OTC”的药物,必需在医生指导下使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液在通电时才可以电离 | B. | 金属氧化物一定都是碱性氧化物 | ||
| C. | 非金属氧化物都是酸性氧化物 | D. | 碱性氧化物一定都是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com