
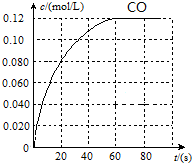
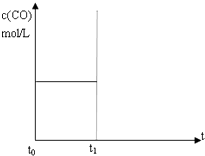
 某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.
某温度下,在恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度均为0.20mol/L,发生反应:H2(g)+CO2(g)?H2O(g)+CO(g).CO(g)的浓度随时间变化如图所示.分析 根据反应方程式:H2(g)+CO2(g)?H2O(g)+CO(g),
起始(mol/L) 0.2 0.2 0 0
转化(mol/L) 0.12 0.12 0.12 0.12
平衡(mol/L) 0.18 0.18 0.12 0.12
(1)根据v=$\frac{△c}{△t}$计算;
(2)转化率=$\frac{已转化的浓度}{起始的浓度}$×100%;
(3)根据K=$\frac{c(H{\;}_{2}O)c(CO)}{c({H}_{2})c(C{O}_{2})}$计算;
(4)降低温度,该反应的平衡常数增大,即平衡正向移动,根据温度对平衡的移动的影响判断.
解答 解:根据反应方程式:H2(g)+CO2(g)?H2O(g)+CO(g),
起始(mol/L) 0.2 0.2 0 0
转化(mol/L) 0.12 0.12 0.12 0.12
平衡(mol/L) 0.18 0.18 0.12 0.12
(1)根据图可知,20s内CO的浓度为0.08mol/L,v(CO)=$\frac{0.08}{20}$mol/(L•s)=0.004mol/(L•s),
故答案为:0.004;
(2)H2(g)的平衡转化率为$\frac{0.12}{0.2}$×100%=60%,
故答案为:60%;
(3)K=$\frac{c(H{\;}_{2}O)c(CO)}{c({H}_{2})c(C{O}_{2})}$=$\frac{0.1{2}^{2}}{0.1{8}^{2}}$=0.44,
故答案为:0.44;
(4)降低温度,该反应的平衡常数增大,即平衡正向移动,而降低温度,平衡向放热方向移动,所以该反应的正反应为放热反应,
故答案为:放热.
点评 本题主要考查了反应速率的计算、转化率的计算、化学平衡常数的计算、影响平衡移动的因素等知识点,难度不大,注意基础知识的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCO3在空气中灼烧 | B. | 铝条插入冷的浓硫酸中 | ||
| C. | Na2O2敞放在空气中 | D. | 向Mg(OH)2悬浊液中加入FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
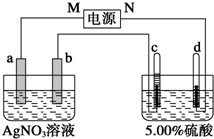 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a+b+c}{V}$mol•L-1 | B. | $\frac{a+b+2c}{V}$mol•L-1 | C. | $\frac{2a+b+c}{V}$mol•L-1 | D. | $\frac{b+2c}{V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO(g)+H2 (g)△H=+131.3kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com