
一定温度下,在体积为 VL 的密闭容器中加入1molX和1molY进行如下反应:
X(g) + Y(g ) 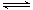 2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
2Z(g )+ W(s) ;△H >0达到平衡,下列判断正确的是( )
| A.向平衡混合物中加入少量W,正、逆反应速率均增大 |
| B.平衡后加入X,上述反应的△H增大 |
| C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的1/2 |
| D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态 |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
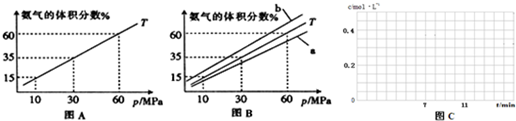
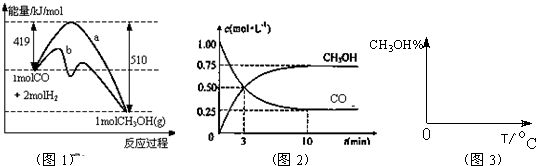
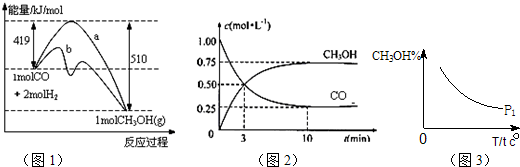
 CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
 CH3OH(g)的平衡常数为
CH3OH(g)的平衡常数为查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com