

| A. | 原子半径:W>Y>X | |
| B. | 气态氢化物的热稳定性:R>W | |
| C. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| D. | RX2溶于水可生成H2RX3的共价化合物 |
分析 为短周期元素,有两种元素既有+4价,又有-4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,据此结合元素化合物的性质分析解答.
解答 解:为短周期元素,有两种元素既有+4价,又有-4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,
A.同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,即Y>W>X,故A错误;
B.非金属性S>Si,故SiH4的稳定性比H2S弱,故B错误;
C.Y为Na元素,Z为Al元素,Y和Z两者最高价氧化物对应的水化物为NaOH和氢氧化铝,二者能相互反应NaOH+Al(OH)3=NaAlO2+2H2O,故C正确
D.R为Si元素,SiO2难溶于水,与水不反应,故D错误;
故选C.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.


科目:高中化学 来源: 题型:选择题
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同位素 | ||
| C. | 13C与15N有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,反应类型为加成反应.
,反应类型为加成反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 元素的非金属性较强,其单质也越活泼 | 磷单质比N2稳定 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸,浓硝酸中铝片先溶解完全 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS黑色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
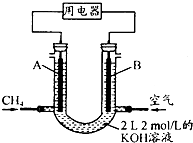 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 23gNO2和N2O4混合气体中含有原子总数为1.5NA | |
| C. | 足量Cu和100mL18mol/L热浓硫酸反应可生成0.9 NA个SO2分子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com