证明某白色晶体是(NH4)2SO4的简单实验操作如下:取少量白色晶体于一小烧杯中,加入适量蒸馏水制成溶液.
(1)证明溶液中含SO2+4,主要的实验操作及现象为:______.发生反应的离子方程式是:______.
(2)证明溶液中含有NH4+,主要实验操作及现象为发生反应的离子方程式是:______ NH3↑+H2O
【答案】
分析:(1)利用Ba
2+与SO
42-反应生成不溶于水与酸的硫酸钡白色沉淀检验SO
42-,所用试剂为盐酸、氯化钡溶液;
(2)利用铵根离子与碱反应生成氨气,氨气使湿润的红色石蕊试纸变蓝,据此检验NH
4+.
解答:解:(1)检验SO
42-的方法为:取少许溶液于试管中,加入稀盐酸后,再甲氯化钡溶液,有白色沉淀产生,说明含有SO
42-,反应离子方程式为:Ba
2++SO
42-=BaSO
4↓,
故答案为:取少许溶液于试管中,加入稀盐酸后,再甲氯化钡溶液,有白色沉淀产生,说明含有SO
42-;Ba
2++SO
42-=BaSO
4↓;
(2)证明溶液中含有NH
4+的方法为:取少许溶液于试管中,加入浓氢氧化钠溶液,加热并湿润的红色石蕊试纸检验气体,试纸变蓝,证明含有NH
4+,反应离子方程式为:NH
4++OH
-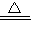
NH
3↑+H
2O,
故答案为:取少许溶液于试管中,加入浓氢氧化钠溶液,加热并湿润的红色石蕊试纸检验气体,试纸变蓝,证明含有NH
4+;NH
4++OH
-
NH
3↑+H
2O.
点评:本题考查硫酸根、铵根离子的检验,难度不大,注意对基础知识的理解掌握.

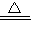 NH3↑+H2O,
NH3↑+H2O, NH3↑+H2O.
NH3↑+H2O.

