
| A. | 950mL、20.14g | B. | 950mL、10.07g | C. | 1000mL、21.20g | D. | 1000mL、10.60g |
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
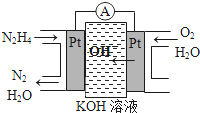 某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定增大 | B. | 一定减小 | ||
| C. | 一定不变 | D. | 可能减小也可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有酯类和糖类都可以发生水解反应 | |
| B. | 分馏石油得到的各个馏分都是混合物 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 动物脂肪和植物油都属于酯类,都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的含氧酸是最强酸 | B. | 原子半径:X>Z | ||
| C. | 气态氢化物热稳定性:W>X | D. | W与Y可以存在于同一离子化合物中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com