
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、0.1 mol?L-1 NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1 mol?L-1Na2S溶液:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、0.01 mol?L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液:c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、1.8g NH4+ 所含原子数为0.1NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4 L |
| C、物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl- 个数为NA |
| D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B、等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C、HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)-C(OH-)=C(CN-)-C(Na+) |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
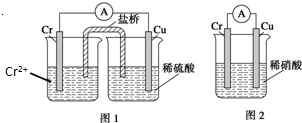 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com