
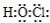 .
.分析 (1)HClO为共价化合物,分子中含有1个O-Cl键和个H-O键,据此写出其电子式;
(2)NaCN易与酸发生反应生成HCN,而HCN有剧毒,故应该使溶液的pH呈碱性;
(3)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,结合氧化还原反应中化合价升降相等配平;
(4)参加反应的NaCN为$\frac{100×(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,利用电子守恒计算.
解答 解:(1)HClO为共价化合物,分子中含有1个O-Cl键和个H-O键,其电子式为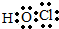 ,
,
故答案为: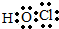 ;
;
(2)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性,
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;
(3)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;
(4)参加反应的NaCN是:$\frac{100×(10.3-0.5)g}{49g/mol}$=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:$\frac{20mol×5}{2}$×74.5g/mol×4=14900g,
故答案为:14900.
点评 本题考查了电子式、氧化还原反应方程式书写、计算等有关判断,题目难度中等,明确氧化还原反应的实质及配平原则为解答关键,试题知识点较多,充分考查了学生的分析能力及灵活应用能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
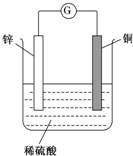 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和 14N 质子数相差 1,中子数也相差1 | |
| B. | 一种元素可以有多种核素,有几种核素就有几种原子 | |
| C. | 钴5627Co、5727Co、5827Co、5927Co等几种原子,他们是同素异形体,其物理性质几乎相同,化学性质不同 | |
| D. | 核聚变如21H+31H→42He+10 n,由于有新微粒生成,该变化是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
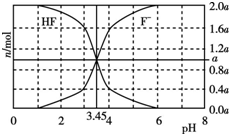 25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3时,溶液中:c(Na+)<c(F-) | |
| B. | 当c(F-)>c(HF)时,一定有c(OH-)>c(H+) | |
| C. | pH=3.45时,NaOH溶液与HF恰好完全反应 | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
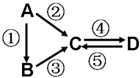 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
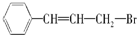 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能使溴水褪色,但不能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol 该有机物可以与4 mol Br2加成 | |
| D. | 在NaOH水溶液中可以发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com