

 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为F.
(1)⑦为Si,原子核外有14个电子,有3个电子层,各层电子数为2、8、4,单质用作半导体材料(或用作太阳能电池板或制作计算机芯片);
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;非金属性增强,非金属性越强,最高价含氧酸的酸性越强、氢化物越稳定;
(3)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水;
(4)⑤、⑥、⑨三种元素的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,氢氧化钠与高氯酸反应生成高氯酸钠与水,氢氧化铝与高氯酸反应生成高氯酸铝与水;
(5)X、Y分别由元素④、⑤和②、④形成,X与Y的反应是潜水艇和呼吸面具中氧气的来源,则X为Na2O2、Y为CO2,二者反应生成碳酸钠与氧气,反应中过氧化钠起氧化剂、还原剂作用,各占一半,计算参加反应过氧化钠物质的量,再根据方程式计算二氧化碳物质的量,根据m=nM计算二氧化碳的质量.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为F.
(1)⑦为Si,原子结构示意图为 ,单质用作半导体材料(或用作太阳能电池板或制作计算机芯片),
,单质用作半导体材料(或用作太阳能电池板或制作计算机芯片),
故答案为: ;用作半导体材料(或用作太阳能电池板或制作计算机芯片);
;用作半导体材料(或用作太阳能电池板或制作计算机芯片);
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>C;同周期自左而右非金属性增强,非金属性增强,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4>H2SiO3,上述元素中F元素非金属性最强,故HF最稳定,
故答案为:Na>Al>C;HClO4>H2SO4>H2SiO3;HF;
(3)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)⑤、⑥、⑨三种元素的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,氢氧化钠与高氯酸反应生成高氯酸钠与水,氢氧化铝与高氯酸反应生成高氯酸铝与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O、OH-+H+=H2O、Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;OH-+H+=H2O;Al(OH)3+3H+=Al3++3H2O;
(5)X、Y分别由元素④、⑤和②、④形成,X与Y的反应是潜水艇和呼吸面具中氧气的来源,则X为Na2O2、Y为CO2,过氧化钠含有离子键、共价键,二者反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,反应中过氧化钠起氧化剂、还原剂作用,各占一半,转移电子为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,故参加反应过氧化钠为$\frac{\frac{0.5mol}{2}}{\frac{1}{2}}$=0.5mol,由方程式可知参加反应二氧化碳为0.5mol,其质量为0.5mol×44g/mol=22g,
故答案为:离子键、共价键;2Na2O2+2CO2=2Na2CO3+O2;22.
点评 本题考查元素周期表与元素周期律应用,注意对基础知识的理解掌握,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
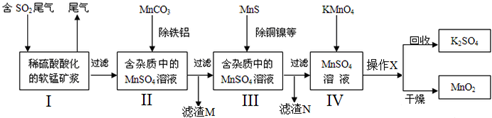
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏能得到石油气、汽油和煤油等清洁能源 | |
| B. |  在如图循环转化过程中,太阳能最终转化为热能 | |
| C. | 煤的干馏是指将煤在空气中加热的过程,工业上也叫煤的焦化 | |
| D. | 糖类、油脂、蛋白质是为了人类生命活动提供能量的基本营养物质,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(X)正=v(X)逆=0 | |
| B. | v(X):v(Y)=1:2 | |
| C. | 容器内X,Y,Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1mol X同时生成0.2mol Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com