
| 容器编号 | 起始各物质的物质的量(mol) | 达到平衡时能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出23.15kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出QkJ能量 |
| A. | 容器①、②中反应的化学平衡常数相等 | |
| B. | 平衡时,两容器中氨的体积分数均约为14.3% | |
| C. | 反应②达到平衡时,放出的热量Q=23.15 kJ | |
| D. | 若①的体积为5.0 L,则达到平衡时放出的热量小于23.15 kJ |
分析 A、化学平衡常数只受温度影响,温度不变化学平衡常数不变;
B、把容器②中,0.2molNH3转化为0.1molN2和0.3molH2,则容器①、②是等效平衡,利用反应热计算生成氨气的物质的量,进而根据化学方程式计算生成氨气的体积分数;
C、反应①、②是等效平衡,②中含有0.2molNH3相当在①的基础上提前反应了0.1mol氮气;
D、若①的体积为5.0 L,压强减小平衡逆向移动.
解答 解:A、化学平衡常数只受温度影响,相同温度下,①、②中反应的化学平衡常数相等,故A正确;
B、①容器中放出23.15kJ热量,则生成氨气的物质的量为:$\frac{2mol×23.15KJ}{92.6KJ}$=0.5mol,利用三段式法计算:
N2(g)+3H2(g)?2NH3(g)△H=一92.6kJ/mol
起始:1mol 3mol 0
转化:0.25mol0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数$\frac{0.5mol}{0.75mol+2.25mol+0.5mol}$=$\frac{1}{7}$,
从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2,在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,均为$\frac{1}{7}$≈14.3%,故B正确;
C、反应①、②是等效平衡,②中含有0.2molNH3相当在①的基础上提前反应了0.1mol氮气,放出的热量小于23.15 kJ,故C错误;
D、若①的体积为5.0 L,压强比①减小平衡逆向移动,达到平衡时放出的热量小于23.15 kJ,故D正确;
故选C.
点评 本题考查化学平衡移动问题,题目难度中等,注意B项从等效平衡的角度分析,为该题的易错点.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫遇水生成亚硫酸,容易引起胃肠道反应 | |
| B. | 人体直接吸入二氧化硫易引起呼吸道疾病 | |
| C. | 二氧化硫引起的环境问题主要是酸雨 | |
| D. | 可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
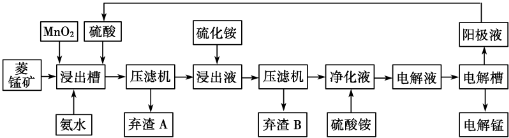
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯与分子式为C29H48的物质可能属于同系物 | |
| C. | 角鲨烯完全加氢后为C30H62 | |
| D. | 1mol角鲨烯最多可与5mol溴单质加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
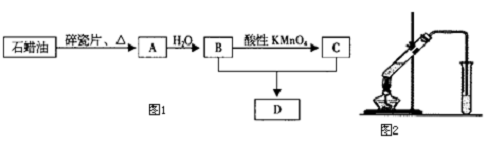
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com