
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.分析 实验室要制备纯净的乙烯并检验乙烯,原理为乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应,因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,要检验乙烯,借助其还原性,能够使酸性的高锰酸钾褪色,但是二氧化硫的存在对乙烯的检验造成干扰,应先检验二氧化硫的存在,然后除去二氧化硫,再用酸性的高锰酸钾检验乙烯的存在.
(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体;
(2)I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用高锰酸钾酸性溶液褪色检验乙烯;
(3)二氧化硫具有漂白性;
(4)二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色;
(5)检验二氧化硫是否除尽;
(6)乙烯具有还原性,能够使酸性的高锰酸钾褪色.
解答 解:(1)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体化学方程式:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O;
故答案为:CH3CH2OH$→_{浓硫酸}^{170℃}$CH2=CH2↑+H2O;
(2)I中检验二氧化硫用品红溶液,II中NaOH除去二氧化硫,Ⅲ中品红检验二氧化硫除尽,Ⅳ中用高锰酸钾酸性溶液褪色检验乙烯;
故答案为:I A;II B;II A;IV D
(3)二氧化硫具有漂白性,能说明SO2气体存在的现象是:装置Ⅰ中 品红褪色;
故答案为:装置Ⅰ中 品红褪色;
(4)二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,为检验乙烯,应除去二氧化硫;
故答案为:除去SO2以免干扰 乙烯的检验;
(5)使用装置Ⅲ的目的是:检验SO2是否被完全除去;
故答案为:检验SO2是否被完全除去;
(6)乙烯具有还原性,能够使酸性的高锰酸钾褪色,确定含有乙烯的现象是:装置III中品红不褪色,装置Ⅳ中酸性 KMnO4溶液褪色;
故答案为:装置III中品红不褪色,装置Ⅳ中酸性 KMnO4溶液褪色.
点评 本题考查了乙烯的实验室制备,侧重考查实验的设计,明确实验原理及物质的性质和除杂检验的方法是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):
A、B、C、D均是由短周期元素形成的四种气体单质,E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
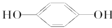
 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2(R、R′代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%. .
. +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$ +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
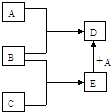 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E; ③
E; ③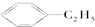 H;
H;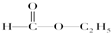 I;⑤
I;⑤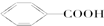 G; ⑥
G; ⑥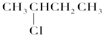 J.
J.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 观察比较外观形态 | B. | 用手触摸比较 | ||
| C. | 放到嘴里品尝一下 | D. | 用化学方法进行鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com