
| A. | 所含共用电子对数为($\frac{a}{7}+1$)NA | B. | 所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是$\frac{33.6a}{14}$L | D. | 所含原子总数为$\frac{a{N}_{A}}{14}$ |
分析 C2H4和C3H6的最简式为CH2,所以ag混合物中含有最简式CH2的物质的量为:$\frac{a}{14g/mol}$=$\frac{a}{14}$mol,ag混合物中含有$\frac{a}{14}$molC原子、$\frac{a}{7}$molH原子,总共含有原子的物质的量为:$\frac{3a}{14}$mol;没有告诉在标准状况下,无法计算燃烧时消耗氧气的体积;在乙烯、丙烯和环丙烷分子中,平均每个碳原子形成一个碳碳键、每个氢原子形成一个碳氢键,据此计算出所含共用电子对数、碳氢键数目.
解答 解:agC2H4和C3H6混合物中含有最简式CH2的物质的量为:$\frac{a}{14g/mol}$=$\frac{a}{14}$mol,则该ag混合物中含有$\frac{a}{14}$molC原子、$\frac{a}{7}$molH原子,
A.在环丙烷、丙烯和乙烯分子中,每个C含有1个碳碳共用电子对、每个H形成了1个碳氢共用电子对,总共含有共用电子对为:$\frac{3a}{14}$mol,故A错误;
B.每个氢原子形成1个碳氢键,ag混合物中总共含有$\frac{a}{7}$molH原子,所以含有$\frac{a}{7}$mol的碳氢键,所含碳氢键数目为$\frac{a}{7}$NA,故B正确;
C.没有告诉在标准状况下,题中条件无法计算ag混合物燃烧消耗的氧气的体积,故C错误;
D.ag混合物中含有最简式CH2的物质的量为:$\frac{a}{14g/mol}$=$\frac{a}{14}$mol,ag混合物中含有$\frac{a}{14}$molC原子、$\frac{a}{7}$molH原子,总共含有原子的物质的量为:$\frac{3a}{14}$mol,所含原子总数为$\frac{3a}{14}$NA,故D错误;
故选B.
点评 本题考查了混合物的计算,题目难度中等,注意掌握最简式在化学计算中的应用,明确物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的关系,C为易错点,需要明确标况下气体摩尔体积的使用条件.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将CCl4滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴水褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增加A的物质的量 | ||
| C. | 使用催化剂 | D. | 缩小容器体积使压强增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
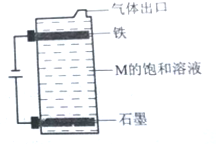 A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.
A、B、C、D、E为原子序数依次增大的短周期元素.A、C处于同一主族,C、D、E处于同一周期;A、B组成的气体X能使湿润的红色石蕊试纸变蓝.C在短周期元素中金属性最强,E原子的最外层电子数是A、B、C原子最外层电子数之和,E的单质与x反应能生成溶于水呈强酸性的化合物Z,同时生成B的单质,D的单质既能与C的最高价氧化物的水溶液反应,也能与Z的水溶液反应;C、E可组成化合物M.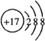 .
.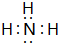 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
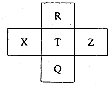 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,R元素原子最外层电子数等于其电子层数的3倍,下列判断正确的是( )| A. | X元素的最高价氧化物对应的水化物酸性强于T元素 | |
| B. | 原子半径:R<T<Z | |
| C. | Z的单质可从T的气态氢化物中置换出T的单质 | |
| D. | R、T、Q最高正价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com