
A、实验室制氨气:NH4++OH-
| ||||
| B、向NaHCO3溶液中滴入少量澄清的石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | ||||
| C、酸性KMnO4溶液与H2O2反应:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | ||||
| D、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、①② | C、②③ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液和稀硫酸反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B、碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O |
| C、氧化亚铁溶于稀盐酸:O2-+2H+=H2O |
| D、稀盐酸滴到石灰石上:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 与
与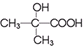 两种有机物,该试剂是
两种有机物,该试剂是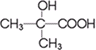 发生缩聚反应生成高分子化合物的结构简式
发生缩聚反应生成高分子化合物的结构简式 ;C、能使Br2的CCl4溶液褪色.
;C、能使Br2的CCl4溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:
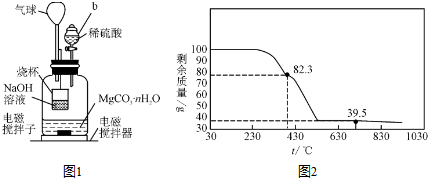
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com