
 ��ͼΪʵ����ijŨ�������Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
��ͼΪʵ����ijŨ�������Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺| 1000�Ѧ� |
| M |
| n |
| V |
| 1000��1.84g/L��98% |
| 98g/mol |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��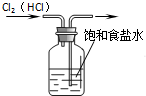 ��ȥCl2�е�HCl���� |
B�� ϡ��ŨH2S04 |
C��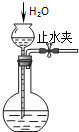 ���װ�������� |
D��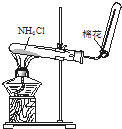 ʵ������ȡNH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ƽ�� | ƽ�ⳣ�� | ||||
Fe3CO3��s��?Fe2+��aq��+CO
| Ksp=3.2��10-11 | ||||
H2CO3?H++HCO
| Ka1=4.36��10-7 | ||||
HCO
| Ka2=4.68��10-11 | ||||
2HCO
| K=1.3��-4 |
- 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
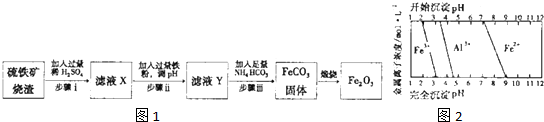
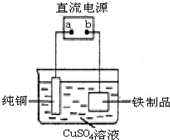 ���ڵؿ��еĺ���Լռ 5%���ң�����ʯ������ܶ࣬��Ҫ���д�����ʯ����Ҫ�ɷ���Fe3O4����������ʯ����Ҫ�ɷ��� Fe2O3���ȣ�
���ڵؿ��еĺ���Լռ 5%���ң�����ʯ������ܶ࣬��Ҫ���д�����ʯ����Ҫ�ɷ���Fe3O4����������ʯ����Ҫ�ɷ��� Fe2O3���ȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��1000K |
| x |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
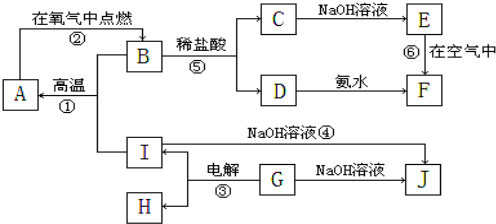
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
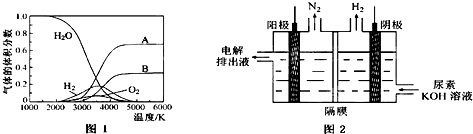
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com