
| A.Fe+H2SO4====FeSO4+H2↑ | B.Br2+2NaI====2NaBr+I2 |
C.2C+SiO2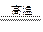 Si+2CO↑ Si+2CO↑ | D.2Al+Fe2O3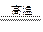 2Fe+Al2O3 2Fe+Al2O3 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:填空题
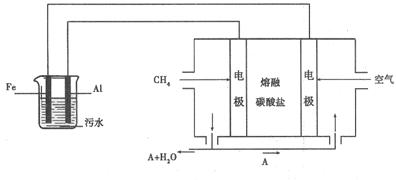
 。
。 。
。 (标准状况) L。
(标准状况) L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ | B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+物质的量比为1∶2 | D.1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CrO3+NH3+H2O | B.Cr2O3+NH3+H2O | C.CrO3+N2+H2O | D.Cr2O3+N2+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Vc将Fe3+还原为Fe2+ | B.Vc解毒未发生氧化还原反应 |
| C.亚硝酸盐是还原剂 | D.Vc是氧化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5∶7 | B.7∶5 | C.7∶11 | D.11∶7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com