
分别取1 mol葡萄糖进行下列试验:
(1)银镜反应时,生成Ag的物质的量为________mol,反应后葡萄糖变为__________________,其结构简式是_____________________________。
(2)与乙酸反应生成酯,从理论上讲完全酯化需要________g乙酸。
(3)若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为________L,反应的化学方程式是____________________________________
________________________________________________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
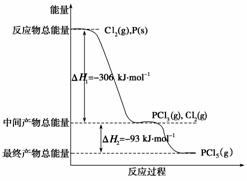
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
________________________________________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是a、b两种不同物质的熔化曲线,下列说法中正确的是 ( )。
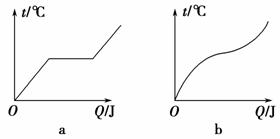
①a是晶体 ②a是非晶体 ③b是晶体 ④b是非晶体
A.①④ B.②④ C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为
_________________________________________________________________。
 的沸点比
的沸点比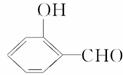 高,原因是_______________________________
高,原因是_______________________________
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中
H—O—H键角比H2O中H—O—H键角大,原因为______________________
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3,
NA表示阿伏加德罗常数,则CaO晶胞体积为________cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
酒精、乙酸和葡萄糖三种溶液,只用一种试剂就能将它们区别开来,该试剂是( )
A.金属钠 B.石蕊试液
C.新制的氢氧化铜悬浊液 D.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
3A(g)+B(g)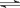 2C(g)+x D(g)△H > 0,5min达平衡,此时生成2molC,测得D的
2C(g)+x D(g)△H > 0,5min达平衡,此时生成2molC,测得D的
平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( )
A.降低平衡体系的温度,逆反应速率减小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中通入一定量SO2后,不会出现沉淀的是( )
A.Na2S溶液 B.BaCl2溶液
C.Ba(NO3)2溶液 D.NaClO和BaCl2混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com