
分析 (1)浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(3)浓硫酸的稀释所用的仪器为烧杯;搅拌的目的是加快热量的散失;
(4)移液时,要将冷却后的溶液沿玻璃棒注入500mL容量瓶中;
(5)定容时,开始直接往容量瓶中加水,待液面离刻度线1-2cm时,该用胶头滴管逐滴加入.
解答 解:(1)浓H2SO4的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,
解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6mL;
(2)由于需要量取13.6mL的浓硫酸,故应选择20mL的量筒;量取浓硫酸时仰视读数,则所量取的浓硫酸的体积偏大,所配溶液浓度将偏高,故答案为:20mL,偏高;
(3)浓硫酸的稀释所用的仪器为烧杯;搅拌的目的是使稀释时产生的热尽快散失,防止因局部过热引起液滴飞溅,故答案为:烧杯,使稀释时产生的热尽快散失,防止因局部过热引起液滴飞溅
(4)移液时,要将冷却后的溶液沿玻璃棒注入500mL容量瓶中,并用50mL蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液要转入到容量瓶中,并振荡,故答案为:玻璃棒,500mL容量瓶;
(5)定容时,开始直接往容量瓶中加水,待液面离刻度线1-2cm时,该用胶头滴管逐滴加入,至凹液面与刻度线相切即可.
故答案为:胶头滴管,凹液面.
点评 本题考查了一定物质的量浓度溶液的配制的误差分析,注意从c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.


科目:高中化学 来源: 题型:选择题
| A. | 电离时生成的阳离子全部是氢离子的化合物叫做酸 | |
| B. | CO2的水溶液可以导电,所以CO2是电解质 | |
| C. | 所有盐均电离出金属阳离子和酸根离子 | |
| D. | 强电解质的溶液导电能力强于弱电解质的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 瓶中气体的黄绿色变浅 | |
| B. | 瓶内壁有油状液滴生成 | |
| C. | 生成物只有CH3Cl和HCl | |
| D. | 此反应的生成物可能是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.已知电池充、放电的化学方程式为2Na2S2+NaBr3 $?_{充电}^{放电}$Na2S4+3NaBr.当闭合开关K时,X极附近溶液先变红色.下列说法中正确的是( )| A. | 闭合K时,装置(Ⅰ)中Na+从右到左通过离子交换膜 | |
| B. | 闭合K时,A电极的电极反应式为NaBr3+2Na++2e-═3NaBr | |
| C. | 闭合K时,X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 闭合K时,当有0.1 mol Na+通过离子交换膜,则X电极上析出气体在标准状况下的体积为1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
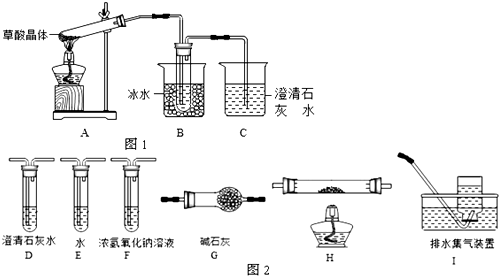
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中加入过量的NaHCO3溶液:HCO3-+Ba2-+OH-═BaCO3↓+H2O | |
| B. | 向小苏打溶液中加入过量石灰水,Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| C. | 向硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO4-+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
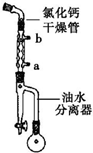 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: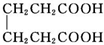 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$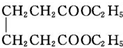 +2H2O
+2H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 己二酸二乙酯 | 202 | 1.01 | 245 | 不溶于水 |
| 己二酸 | 146 | 1.36 | 231.8 | 微溶 |
| 乙醇 | 46 | 0.79 | 78.4 | 混溶 |
| 甲苯 | 92 | 0.87 | 110.6 | 不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com