
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
分析 A.碳酸为二元弱酸,电离方程式分步书写,主要以第一步书写;
B.硫酸氢钠在溶液中完全电离出钠离子、氢离子和硫酸根离子;
C.亚硫酸根离子的水解分步进行,离子方程式需要分步书写;
D.碳酸氢根离子水解生成碳酸和氢氧根离子.
解答 解:A.碳酸的电离方程式应该分步书写,其正确的电离方程式为:H2CO3═H++HCO3-,故A错误;
B.NaHSO4为强电解质,其电离的方程式为:NaHSO4═Na++H++SO42-,故B正确;
C.亚硫酸钠水解分步进行,主要以第一步为主,正确的离子方程式为:SO32-+H2O?HSO3-+OH-,故C错误;
D.HCO3-+H2O?CO32-+H3O+为碳酸氢根离子的电离,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握电离方程式、水解方程式的书写原则,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和 ,放出28
,放出28 .
. 7kJ的热量
7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
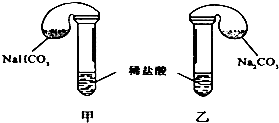 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 | |
| B. | 硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量硫酸亚铁铵晶体放入试管,加入浓氢氧化钠溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下11.2L的水中含有0.5 NA个水分子 | |
| B. | 22.4LN2所含的电子数是14NA个 | |
| C. | 常温常压下,1 mol N2和NO的混合气体中含2NA个原子 | |
| D. | 含107g Fe(OH)3的胶体中胶粒总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③⑤⑥ | D. | ①②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com