
| A. | 硒化氢不稳定 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 得电子能力强于硫 | |
| D. | 其最高价氧化物的水化物酸性强于砷弱于溴 |
分析 根据Se位于元素周期表中的第四周期第ⅥA族,硒与氧、硫同主族,性质与S类似,非金属性O>S>Se,非金属性越强,其氢化物越稳定,最高价氧化物的水化物的酸性越强,并利用类推法来解答.
解答 解:A.非金属性:S>Se,氢化物的稳定性:H2S>H2Se,则硒的氢化物H2Se不稳定,故A正确;
B、H2Se与H2S性质类似,H2S的水溶液显弱酸性,则硒化氢的水溶液显弱酸性,故B正确;
C、非金属性越强,则得电子能力越强,所以得电子能力弱于硫,故C错误;
D、非金属性Br>Se>As,则最高价氧化物的水化物的酸性HBrO4>H2SeO4>H3AsO4,故D正确;
故选C.
点评 本题考查学生利用元素周期律来解答,明确同主族元素性质的相似性和递变性是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 除(7)外都可以 | B. | 除(6)外都可以 | C. | (1)(2)(3)(7) | D. | (1)(2)(3)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H+H→H-H | B. | 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2KOH=K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
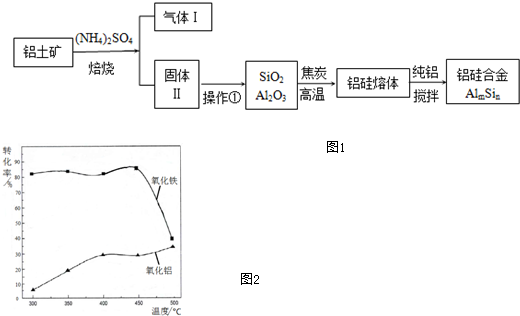
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的 | |
| B. | Na在氧气中燃烧主要生成Na2O | |
| C. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 转移0.1mol电子时,a电极产生1.12LH2 | |
| B. | b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- | |
| C. | c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池 | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
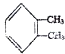 ;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为
;若C8H10分子中苯环上的一氯代物有三种,则其结构简式为 或
或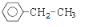 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | 只有⑤ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com