
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na
【答案】C
【解析】
合金是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,也就是说,一种金属熔化时,另一种金属或非金属也熔化。如果一种金属还没熔化,而另一种金属已经变为蒸气了,则不能熔合成合金。也就是说,一种金属的熔点必须低于另一种金属的沸点时,二种金属才能熔合。
A. Cu和Al,Cu的熔点1083![]() ,Al的沸点是2200
,Al的沸点是2200![]() ,二者可以共同熔化;
,二者可以共同熔化;
B. Fe和Cu,Fe的熔点是1535![]() ,Cu的沸点是2595
,Cu的沸点是2595![]() ,二者可以共同熔化;
,二者可以共同熔化;
C. Fe和Na,Fe的熔点是1535![]() ,Na的沸点是883
,Na的沸点是883![]() ,也就是说,Fe还未熔化时,Na就已经变为蒸气了,二者不能共同熔化;
,也就是说,Fe还未熔化时,Na就已经变为蒸气了,二者不能共同熔化;
D. A1和Na,A1的熔点是660![]() ,Na的沸点是883
,Na的沸点是883![]() ,二者可以共同熔化。
,二者可以共同熔化。
故选C。


科目:高中化学 来源: 题型:
【题目】某学习小组根据高中知识设计如下测定室内甲醛含量的装置(夹持装置已略)。

I.配制银氨溶液
⑴盛装AgNO3溶液的仪器D的名称_____________。
⑵关闭K2和K3,打开K1和分液漏斗活塞,将饱和食盐水滴入到圆底烧瓶中,当观察到D中最初生成的白色沉淀恰好完全溶解时,关闭K1和分液漏斗活塞。请写出A装置中发生反应的化学方程式_________;饱和食盐水的用途是________。
Ⅱ.测定室内空气中甲醛含量
⑶用热水浴加热D,打开K3,将滑动隔板由最左端抽到最右端,吸入1L室内空气,关闭K3,后续操作是_______________。
⑷装置中毛细管的作用是________________。
⑸已知甲醛被银氨溶液氧化的化学方程式为:HCHO+4Ag(NH3)2OH=(NH4)2CO3+4Ag↓+6NH3↑+2H2O,测得共生成Ag 2.16mg。则空气中甲醛的含量为_______mg.L-1(空气中其它物质不与银氨溶液反应)。
⑹该设计装置存在一个明显的不足之处是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质.
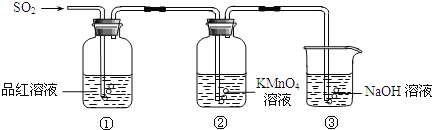
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是 .
(2)当观察到②中溶液颜色变浅时,①中的现象是 .
(3)装置③的作用是 .
(4)①、②中的现象说明二氧化硫具有的性质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。回答下列问题:
(1)基态硼的电子排布图为__,基态镁原子的电子运动状态有__种。
(2)BF3的键角(填“大于”、“小于”或“等于”)__NF3的键角,理由是__。
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是__。
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为__;B的配位数是__。

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为__g/cm3(用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.在标准状况下,78.0 g苯中含有碳碳双键的数目为3NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.在标准状况下,2.24 L CHCl3中所含碳氢键的数目为0.1NA
D.0.1 molL-1的Na2CO3溶液中,![]() 的数目小于0.1NA
的数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是

A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
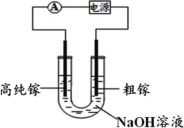
【题目】镓(31Ga)、锗(32Ge)都是重要的稀有金属,在化学催化剂、半导体材料、新能源等领域应用广泛,可从锗煤燃烧后的粉煤灰(含 Ga2O3、GeO2、SiO2、Al2O3)中提取, 部分流程如下:

已知:
物质 | GaCl3 | GeCl4 | AlCl3 |
沸点/℃ | 201 | 84 | 183(升华) |
(1)滤渣的主要成分为_____。
(2)①中发生的反应有 Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O 和_____。
(3)操作 a 的名称是_____,②中控制温度的范围是_____(填字母序号)。
a.20~84℃ b.84~183℃ c.84~201℃
(4)④中发生反应的化学方程式是__________________________________________。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:______________________
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取 Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
(7)电解法可以提纯粗镓,具体原理如图所示。镓在阳极溶解生成的 Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电的电极反应式是_____________________。
在阴极放电的电极反应式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com