
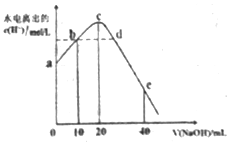
 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
分析 A.醋酸溶液中存在CH3COOH?CH3COO-+H+,加NaOH溶液消耗氢离子,醋酸的电离平衡正移;
B.c点,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显碱性,氢氧化钠体积小于20mL时的某一个值恰好使溶液显中性;
C.c点,醋酸的物质的量是NaOH的物质的量2倍,根据物料守恒分析;
D.d点,NaOH过量,pH大于7,水的电离被抑制;
解答 解:A.醋酸溶液中存在CH3COOH?CH3COO-+H+,加NaOH溶液消耗氢离子,醋酸的电离平衡正移,所以从a到c,醋酸的电离始终受到促进,故A正确;
B.c点,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显碱性,氢氧化钠体积小于20mL时的某一个值恰好使溶液显中性,所以从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点,故B正确;
C.c点,醋酸的物质的量是NaOH的物质的量2倍,溶液中物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),故C正确;
D.a点醋酸部分电离,醋酸电离的氢离子浓度小于0.01mol/L,所以水电离的氢离子浓度>10-12mol/L,d点,NaOH过量,pH大于7,水的电离被抑制,则d点水电离的氢离子浓度<10-7mol/L,故D错误;
故选D.
点评 本题考查酸碱混合溶液的定性判断,明确图象中各点的pH及溶液中的溶质即可解答,注意物料守恒及影响电离平衡的因素,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成15.68LN2(标准状况) | |
| B. | 有0.1molKNO3被氧化 | |
| C. | 转移电子的物质的量为0.25mol | |
| D. | 被氧化的N原子的物质的量为1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 用浓盐酸酸化KMnO4溶液以增强其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | cbadef | B. | dacfbe | C. | badcfe | D. | cbadfe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 0.1 mol/L | D. | 1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2O分子中氧原子为sp3杂化 | |
| B. | Cr原子价电子排布式:3d54s1 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | S原子的电子排布图: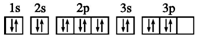 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com