
【题目】硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐。其中无氧酸的酸式盐的化学式是________________。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2![]() 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是______________________________。其中氧化剂与还原剂物质的量之比为______________。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____________。
②你认为减少酸雨产生的途径可采取的措施是____________________(填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
【答案】KHS 10 SO2+ 2CO ![]() S + 2CO2 1:2 2CaCO3 + 2SO2 + O2
S + 2CO2 1:2 2CaCO3 + 2SO2 + O2![]() 2CaSO4 + 2CO2 acd
2CaSO4 + 2CO2 acd
【解析】
(1)硫化氢为无氧酸,KHS为无氧酸的酸式盐;
(2)根据化合价变化分析转移电子数;
(3)CO和SO2在一定条件下可转化为一种固体和一种无害气体,发生了氧化还原反应,有元素化合价的变化可判断固体为硫,无害气体为二氧化碳;根据化合价的变化确定氧化剂和还原剂及其物质的量之比;
(4)①在高温条件下,碳酸钙和二氧化硫、氧气反应生成硫酸钙和二氧化碳;
②减少酸雨产生的根本途径是减少二氧化硫气体的排放,以此分析。
(1)根据硫化氢与碳酸钠发生复分解反应的特点,结合题中反应生成两种酸式盐的信息,可写出反应的化学方程式为H2S+K2CO3═KHS+KHCO3,其中KHS为无氧酸的酸式盐;
故答案为:KHS;
(2)2COS+3O2![]() 2CO2+2SO2中,1molO2得4mol电子,则2mol COS(羰基硫)与3mol O2反应,共转移12 mol电子,若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是
2CO2+2SO2中,1molO2得4mol电子,则2mol COS(羰基硫)与3mol O2反应,共转移12 mol电子,若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是![]() mol=10mol。
mol=10mol。
故答案为:10;
(3)CO和SO2在一定条件下可转化为一种固体和一种无害气体,发生了氧化还原反应,有元素化合价的变化可判断固体为硫,无害气体为二氧化碳,所以该反应的化学方程式是SO2+ 2CO ![]() S + 2CO2。该反应中硫的化合价降低,二氧化硫作氧化剂,碳元素化合价升高,一氧化碳作还原剂,所以氧化剂与还原剂物质的量之比为1:2;
S + 2CO2。该反应中硫的化合价降低,二氧化硫作氧化剂,碳元素化合价升高,一氧化碳作还原剂,所以氧化剂与还原剂物质的量之比为1:2;
故答案为:SO2+ 2CO ![]() S + 2CO2 ;1:2;
S + 2CO2 ;1:2;
(4)①在高温条件下,碳酸钙和二氧化硫、氧气反应生成硫酸钙和二氧化碳,所以反应的化学方程式是2CaCO3 + 2SO2 + O2![]() 2CaSO4 + 2CO2;
2CaSO4 + 2CO2;
②a.避免直接用高硫煤作燃料,可以减少酸雨的产生,故a正确;
b.工厂烟囱造高不能减少二氧化硫的排放,故b错误;
c.燃料脱硫可以减少二氧化硫的生成,故c正确;
d.开发新能源能减少二氧化硫的生成,故d正确。
故答案为:2CaCO3 + 2SO2 + O2![]() 2CaSO4 + 2CO2;acd。
2CaSO4 + 2CO2;acd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减少或不变
C. 自发反应在任何条件下都能实现
D. 自发反应在恰当条件下才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是![]()
![]()
A. 向含2molFeBr2的溶液中通入2molCl2:2Fe2++Cl2═2Cl-+2Fe3+
B. 向2molNaAlO2溶液中滴加5molHCl溶于水中:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O
D. 往氢氧化钠溶液中通入少量SO2与水反应OH- + SO2 = HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中生成物的总能量高于反应物的总能量的是( )
A. HCl + NaOH = NaCl+H2O B. CaO+H2O=Ca(OH)2
C. 2Na + 2H2O = 2NaOH+H2↑ D. H—Br → H + Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:![]()
B. 2-甲基-2-戊烯的键线式:![]()
C. ![]() 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为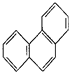 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
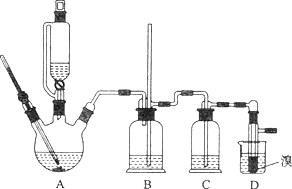
【题目】实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
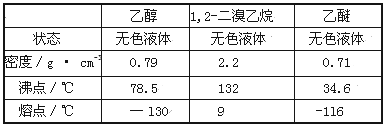
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式:________、_________。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________(填正确选项前的字母,下同)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是______________(填实验现象)。
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(6)若产物中有少量副产物乙醚,可用_______________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com