
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式:_____________。
(2)在海洋循环中,通过如图所示的途径固碳。

①写出钙化作用的离子方程式:_____________。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整:_____________+_____________=(CH2O)x+x18O2+xH2O,_____________
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图所示),将虚线框中的装置补充完整并标出所用试剂。_____________

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymLHCl溶液,海水中溶解无机碳的浓度=_____________mol/L。
【答案】CO2+H2O![]() H2CO3,H2CO3
H2CO3,H2CO3![]() HCO3-+H+ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O xCO2 2xH218O
HCO3-+H+ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O xCO2 2xH218O 
![]()
【解析】
(1)CO2溶于水生成碳酸,碳酸是弱电解质,在水中部分发生电离;
(2)①由图可知,钙化作用过程是碳酸氢根离子转化生成碳酸钙,据此书写离子方程式;
②光合作用是CO2与水在太阳光作用下,在叶绿体中反应生成有机物、放出氧气的过程,氧气来源于水中的氧;
(3)①需从酸化后的海水中吹出二氧化碳,那么就需要滴加稀酸酸化,且装置应从长管进氮气,从短导管吹出二氧化碳;
②依据原理NaHCO3+HCl=NaCl+CO2↑+H2O 。
(1)溶于海水的CO2与水结合生成碳酸,碳酸电离生成碳酸氢根离子HCO3-,故CO2溶于水产生HCO3-的方程式:CO2+H2O![]() H2CO3,H2CO3
H2CO3,H2CO3![]() HCO3-+H+ ;
HCO3-+H+ ;
(2)①反应物中含有碳酸氢根离子,生成物为碳酸钙,依据元素守恒、电荷守恒得出离子方程式为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O;
②光合作用产生的氧气来源于水,即水中的氧原子采用示踪法标记为18O,依据元素守恒配平方程式, xCO2+2xH218O=(CH2O)x+x18O2+xH2O ;
(3)①酸化海水,可以使用试剂:稀硫酸、利用分液漏斗滴加,长管进气,短管出气,故装置为 ;
;
②滴定过程中发生的反应为NaHCO3+HCl=NaCl+CO2↑+H2O,故n(NaHCO3)=n(HCl)=xmol/L×y×10-3L,根据C守恒,海水中溶解无机碳的浓度=![]() =
=![]() mol
mol![]() L-1。
L-1。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期原子序数依次增大的主族元素,其原子序数之和为30,W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性,四种元素形成的某种化合物的结构式为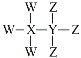 。下列说法错误的是
。下列说法错误的是
A.X为硼元素或碳元素
B.Y不属于第ⅣA族元素
C.W与Y、Z分别形成的常见化合物能反应生成盐
D.最高价氧化物对应的水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以检验某品牌茶叶中铁元素的存在并测定钙元素的质量分数(已知CaC2O4为白色沉淀物质)。首先取200g茶叶样品进行如图操作:
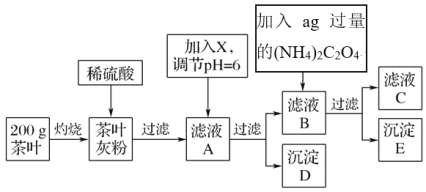
已知:①文献资料显示:某些金属离子的氢氧化物完全沉淀时的pH为:Ca(OH)2:13,Fe(OH)3:4.1
②(NH4)2C2O4溶液显酸性。
(1)实验前要先将茶叶样品高温灼烧为灰粉,需要用到的实验仪器有酒精灯、三脚架、玻璃棒、泥三角________,其主要目的是___________________。
A.蒸发皿 B.坩埚C.石棉网
(2)从滤液A→沉淀D的过程中需要加入的物质X可以选择________。
A.CaO B.Ca(OH)2C.NH3·H2O
(3)用酸性KMnO4标准溶液滴定滤液C时发生的反应为:5C2O42-+2MnO4-+16H+===10CO2↑+2Mn2++8H2O。将滤液C稀释至250mL,取25.00mL溶液,用硫酸酸化后,用0.10mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液体积如表所示:
编号 | KMnO4溶液体积/mL |
1 | 19.98 |
2 | 22.00 |
3 | 20.02 |
①此步操作过程中需要用到图示中哪些仪器________
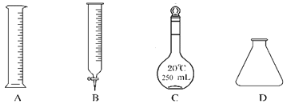
②滴定达到终点时的现象是__________________________。
③为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,若不洗涤沉淀D,会使测定的钙元素的含量________(偏低、偏高、无影响,下同),若不洗涤沉淀E,会使测定的钙元素的含量________。
④原茶叶中钙元素的质量分数为________。(用含a的代数式表示,已知(NH4)2C2O4的摩尔质量为124g·mol-1)。
(4)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
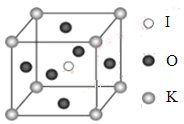
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
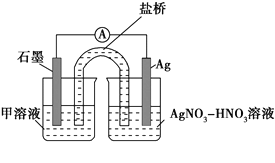
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
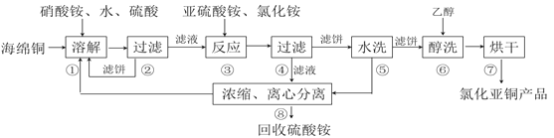
【题目】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~70度,原因是__________。
(2)写出步骤③中主要反应的离子方程式___________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________(填字母)
A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶气体为NH3,气体的物质的量为0.2mol。
①气体的质量为______,气体中含氢原子的物质的量为____ mol。
②气体中所含分子数为_____。
③气体在标准状况下的体积为______。
④将气体甲完全溶解于水中形成500mL溶液,所得溶液溶质的物质的量浓度为______ molL-1。
⑤将④中所得溶液取出100mL,加水稀释至1000ml,所得溶液溶质的物质的量浓度为 ______ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为![]() ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
,反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是( )
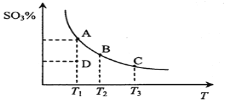
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
C.若B、C点的平衡常数分别为KB、KC,则KB> KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种气体,A是密度最小的气体,B在通常情况下呈黄绿色,纯净的A可以在B中安静地燃烧生成C。把气体B通入到适量石灰乳中可以得到白色浑浊物D。请据此回答下列问题:
(1)写出下列各反应的化学方程式
①纯净的A在B中安静地燃烧生成C_______________
②将气体B通入到水中:__________。
③将气体B通入到NaOH溶液中:_______________________
④将气体B通入到适量石灰乳中:_______________________
(2)把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是________(用字母表示)。
(3)将白色浑浊物D溶于水得到澄清溶液,分别取适量该澄清液两份。
①向第一份中滴加碳酸钠溶液观察到出现沉淀,发生反应的化学方程式为______________、________。
②向第二份溶液中滴加硝酸酸化的硝酸银溶液,会观察到____________(填现象)。
③白色浑浊物D因具有漂白性又称为______________,该物质在空气中容易变质的原因为_______________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com