分析:(1)A.植树造林保护森林,保护植被,能增强光合作用,大量消耗二氧化碳;
B.加大对煤和石油的开采,并鼓励使用石油液化气,能增加二氧化碳的排放;
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高,节约用电、用气,可以节能减排;
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率,可以减少废气的排放和节约能源;
(2)根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式;
(3)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;根据v=
计算v(CO
2),再利用速率之比等于化学计量数之比计算v(H
2);
(4)①温度越高、越强越大,反应速率越快,最先到达平衡;②根据CO转化率计算参加反应的CO的物质的量,再根据方程式计算平衡时混合气体总物质的量变化量,进而计算平衡时混合气体总物质的量,据此解答;
(5)燃料电池中燃料在负极失电子发生氧化反应,碱溶液中生成碳酸钾,氧气在正极得到电子生成氢氧根离子.
解答:
解:(1)A.植树造林,保护森林,保护植被,能增强光合作用,大量消耗二氧化碳,不符合题意,故A错误;
B.加大对煤和石油的开采,并鼓励使用石油液化气,能增加二氧化碳的排放,符合题意,故B正确;
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高,能减少电的使用,减少煤和石油化石燃料的使用,减少二氧化碳的排放,不符合题意,故C错误;
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率,减少石油化石燃料的使用,可以减少废气的排放和节约能源,不符合题意,故D错误;
故选B;
(2)根据质量守恒定律的微观解释可以知道:反应前后的原子数目和种类应该相等,分析题给的化学反应方程式可以知道,反应前出现了2个O,1个C,8个H,反应后出现了2个O,4个H,所以在X中含有4个H和1个C,
故答案为:CH
4;
(3)A.平衡时各物质的浓度保持不变,CO
2百分含量保持不变,说明到达平衡,故A正确;
B.开始投料比,2mol CO
2和6mol H
2,容器中H
2浓度与CO
2浓度之比为3:1,所以不能证明达平衡状态,故B错误;
C.容器的体积不变,反应前后都为气体,容器中混合气体的质量始终保持不变,不能说明到达平衡,故C错误;
D.CO
2生成速率表示逆反应速率,与CH
3OH生成速率表示正反应速率,两者相等,说明到达平衡,故D正确;
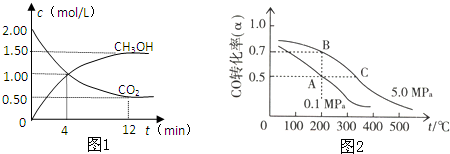
由图可知,12min到达平衡时二氧化碳的浓度变化量为2mol/L-0.5mol/L=1.5mol/L,所以v(CO
2)=
=0.125mol/(L?min),速率之比等于化学计量数之比,所以v(H
2)=3v(CO
2)=3×0.125mol/(L?min)=0.375mol/(L?min),
故答案为:AD;0.375;
(4)①C点的温度、压强都高于A点,温度越高、越强越大,反应速率越快,最先到达平衡,故则从反应开始至到达平衡状态所需的时间t
A>t
C,
故答案为:大于;
②A点CO的转化率为0.5,则参加反应的CO为10mol×0.5=5mol,则:
CO(g)+2H
2(g)?CH
3OH(g)气体物质的量减少
1 2
5mol 10mol
故A点平衡时,混合气体总的物质的量=10mol+20mol-10mol=20mol,
B点CO的转化率为0.7,则参加反应的CO为10mol×0.7=7mol,则:
CO(g)+2H
2(g)?CH
3OH(g)气体物质的量减少
1 2
7mol 14mol
故B点平衡时,混合气体总的物质的量=10mol+20mol-14mol=16mol
故A、B两点时容器内总气体的物质的量之比n(A):n(B)=20mol:16mol=5:4,
故答案为:5:4;
(5)甲醇-空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,氧气在正极得到电子发生还原反应,电极反应为:O
2+2H
2O+4e
-=4OH
-(或3O
2+6H
2O+12e
-=12OH
-),
故答案为:O
2+2H
2O+4e
-=4OH
- (或3O
2+6H
2O+12e
-=12OH
-).



 已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.