
(16分)二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l) △H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l) △H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO (g) + H2O (l) △H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
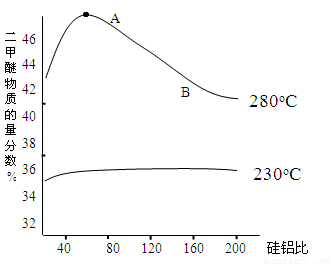
反应③的平衡常数表达式为 ,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律: ___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是 。
(1)2CO2(g)+6H2(g) = CH3OCH3(g)+3 H2O(l) △H =-134.8kJ/mol (3分)
(2)K=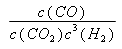 (2分) “=” (2分)
(2分) “=” (2分)
a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小。(其它正确答案均可得分,2分)
(3)起始状态c(H2)=c(CO2)=2mol/2L=1mol/L
2CO2+6H2=CH3OCH3+ 3H2O
c(起始) 1.00mol/L 1.00mol/L 0 0
c(转化) 0.30mol/L 0.90mol/L 0.15mol/L 0.45mol/L
c(平衡) 0.70mol/L 0.10mol/L 0.15mol/L 0.45mol/L
CO2的转化率=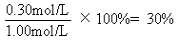 (2分,答案正确且有过程均给2分)
(2分,答案正确且有过程均给2分)
(4)负 (2分) CH3OCH3+16OH--12e-═2CO32-+11H2O (3分,配平错误只扣1分)
【解析】
试题分析:(1)CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热学方程式2CO2(g)+6H2(g)= CH3OCH3(g)+3H2O(l),根据盖斯定律,分析反应①、②及该反应的关系可知,将①式乘以2并加上②式可得该反应,故△H =2△H1+△H2=-23.4 kJ/mol ×2+(-55.7 kJ/mol)=-134.8kJ/mol;(2)反应③中的生成物水是纯液体,浓度为常数,故平衡常数表达式为: K=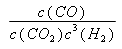 ;平衡常数只受温度影响,图中280oC下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230oC的曲线变化相对平缓,280oC的曲线变化程度较大且先升后降,280oC二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,故可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;等等。
;平衡常数只受温度影响,图中280oC下的A点和B点的平衡常数相等;从图中两条曲线的变化趋势及对比情况可以看出:230oC的曲线变化相对平缓,280oC的曲线变化程度较大且先升后降,280oC二甲醚物质的量分数较大,温度升高,二甲醚的物质的量浓度的变化受影响的程度也有所改变等,故可以概括为:a.温度越高,二甲醚的选择性越大;b.低温时硅铝比对二甲醚的选择性影响不大,高温时随着硅铝比增大,二甲醚的选择性先增大后减小;等等。
(3)依题意可知,起始状态c(H2)=c(CO2)=2mol/2L=1mol/L
2CO2 + 6H2 = CH3OCH3 + 3 H2O
c(起始) 1.00mol/L 1.00mol/L 0 0
c(转化) 0.30mol/L 0.90mol/L 0.15mol/L 0.45mol/L
c(平衡) 0.70mol/L 0.10mol/L 0.15mol/L 0.45mol/L
CO2的转化率=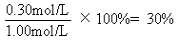
(4)在二甲醚燃料电池中,二甲醚作为燃料,氧气作为氧化剂,故二甲醚应通入负极,碱性条件下,燃料电池中负极上燃料失电子发生氧化反应,该电极反应式为: CH3OCH3+16OH--12e-═2CO32-+11H2O 。
考点:考查热化学方程式、化学平衡常数的应用及燃料电池电极反应式。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)已知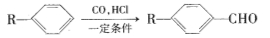
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
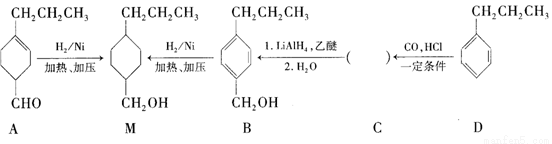
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4c.乙酸乙酯d.KMnO4/H+溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物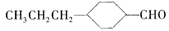 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
B | SO2有氧化性 | SO2可用于漂白纸浆 |
C | NH3极易溶于水 | NH3可用作制冷剂 |
D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 = -393.5 kJ/mol
CO2(g) ΔH1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 = -571.6 kJ/mol
2H2O(l) ΔH 3 = -571.6 kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 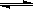 2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2 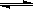 2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3—
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42—、HCO3—
C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN-
D.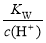 =0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
=0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
查看答案和解析>>
科目:高中化学 来源:2015届广东省增城市毕业班调研测试理科综合化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是
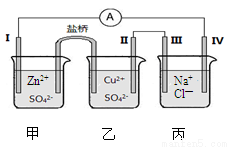
A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl—向乙池移动
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:填空题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
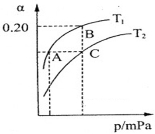
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(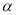 )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
短周期元素的X、Y、Z、W原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比原子Y原子多1,W与X同主族,则
A.气态氢化物的稳定性:X>W
B.单质的还原性:Y>Z
C.原子半径:Y<Z<W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(16分)Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ、市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
实验步骤 | 预期现象或结论 |
步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
步骤2: |
|
步骤3: |
|
Ⅱ、利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
② 滴定:取10.00mL 0.01mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2 === S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2) 完成并配平步骤②中的离子反应: Cr2O72- + ( ) + I-= I2 + Cr3+ + H2O。
(3) 步骤③中,指示剂最好选用 ,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是 。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com