
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究。

(1)X固体为_________(填化学式),装置E的名称是_________。
(2)氯气与NaOH溶液、NaHCO3溶液都会发生反应,生成物均含有+1价氯的物质,其化学式分别为____________________、___________。
(3)将反应后的装置C溶液,从pH=11调到pH=5的过程中,其溶液的漂白性逐渐_____,理由是_____________。
(4)装置C需要冰水浴,否则产率大大下降,原因是__________。
【答案】KMnO4 干燥管 NaClO HClO 增强 随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强 氯气与碱反应放热,使NaClO分解
【解析】
装置A中固体X和浓盐酸在常温下反应生成氯气,氯气中含氯化氢气体,通过装置B中饱和食盐水除去氯化氢,通入装置C中与氢氧化钠溶液反应生成氯化钠、次氯酸钠,通过碳酸氢钠溶液,可以除去反应剩余的氯气,最后通过碱石灰吸收尾气中氯气,防止污染环境,据此分析解答。
(1)装置A中固体X和浓盐酸在常温下反应生成氯气,可以选用高锰酸钾;根据图示,装置E为干燥管,故答案为:KMnO4;干燥管;
(2)氯气与NaOH溶液反应的方程式为Cl2+2NaOH=NaCl+NaClO+H2O;氯水中存在平衡Cl2+H2OHCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大,在碳酸氢钠溶液中得到HClO,故答案为:NaClO;HClO;
(3)反应后的装置C溶液中含有NaClO,将溶液从pH=11调到pH=5的过程中,随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强,故答案为:增强;随着pH的降低,c(H+)增大,反应生成的c(HClO)也增大,溶液的漂白性逐渐增强;
(4)氯气与碱的反应为放热反应,升高温度会使次氯酸钠分解,因此装置C需要冰水浴,否则产率大大下降,故答案为:氯气与碱反应放热,使NaClO分解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )
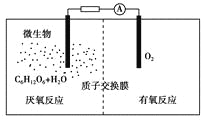
A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电催化合成氨的装置如图所示。该装置工作时,下列说法正确的是
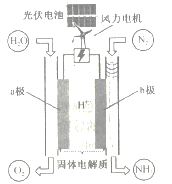
A. 图中涉及的能量转化方式共有3种
B. 两极产生的气体的物质的量之比是1:1
C. 电路中每通过1mol电子,有1mol H+迁移至a极
D. b极上发生的主要反应为N2+6H++6e-=2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6 mol/L的稀硫酸,其他试剂任选。
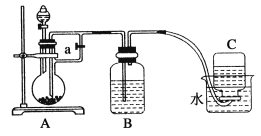
请回答下列问题:
(1)B装置中盛有一定量的NaOH溶液,A装置中应预先加入的试剂是________,A装置中发生反应的离子方程式是___________。
(2)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(3)简述制取Fe(OH)2的操作过程__________________。
(4)实验完毕,拔去B装置中的橡胶塞,放入一部分空气,此时B装置中发生反应的化学方程式为_______________________。
(5)在下图中,装置________(填序号)能较长时间观察到Fe(OH)2白色沉淀。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:![]()
②MgCl2的电子式:![]() ③质量数为133、中子数为78的铯原子:
③质量数为133、中子数为78的铯原子:![]() Cs
Cs
④乙烯、乙醇结构简式依次为:CH2=CH2、C2H6O ⑤S2﹣的结构示意图:![]()
⑥次氯酸分子的结构式:H-O-Cl ⑦CO2的分子模型示意图:![]()
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素;B元素原子最外层上的电子数是其电子层数的2倍;A和C之间可形成A2C和A2C2两种化合物;D在同周期主族元素中原子半径最大,请回答下列问题。
(1)C元素在元素周期表中的位置是____________;C、D两种元素所形成的简单离子,离子半径由大到小的顺序是________________。(用离子符号表示)
(2)写出A2C2的电子式__________。
(3)在恒温下,体积为2 L的恒容容器中加入一定量的B单质和1 mol A2C蒸汽,发生:B(s)+A2C(g) BC(g)+A2(g)。2 min后,容器的压强增加了20%,则2 min内A2C的反应速率为________。一段时间后达到平衡,下列说法正确的是__________。
A.增加B单质的量,反应速率加快
B.恒温恒容时在该容器中通入Ar,反应速率加快
C.气体的密度不再变化可以判断该反应达到了平衡
D.2 min时,A2C的转化率为80%
E.气体的平均摩尔质量不变时,该反应达到平衡
(4)BC与C2在DCA溶液中可形成一种燃料电池。该电池的负极反应式为:___________。
(5)将0.2 mol D2C2投入到含有0.1 mol FeCl2的水溶液中恰好充分反应,反应的总化学方程式为:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)A、D、F形成化合物的电子式_____________。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC, —定条件下,2 min达平衡时生成0.4mol A2,则用BC表示的反应速率为________。下列关于该反应的说法中正确的是__________________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 molA2,转移2mol电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:
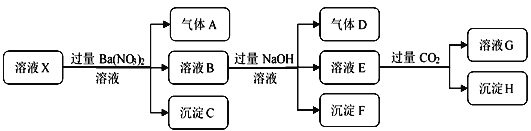
下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于分离或提纯物质的方法有:过滤、蒸发结晶、蒸馏、萃取、分液、洗气。根据需求填下列装置的序号并填上操作名称:


(1)用CCl4提取碘水中的碘,选________,操作名称为________.
(2)用澄清石灰水吸收O2中混有的少量杂质CO2,选________,离子方程式为________。
(3)分离饱和氯化钾溶液与碳酸钙的混合物,选________,操作名称为________。
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物,选________,操作名称为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com