
| A. | 氢氧化钠 | B. | 硝酸银 | C. | 氯化钡 | D. | 氢氧化钡 |
科目:高中化学 来源: 题型:解答题
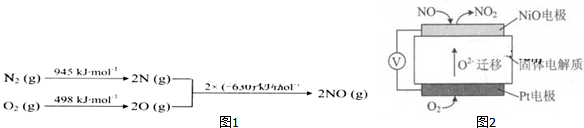
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质的名称为 2,2,3-三甲基-3-丁烯 | |
| B. | 分子中最多 4 个碳原子共平面 | |
| C. | 此物质转化为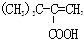 的过程中需依次经过加成、取代、氧化、消去反应 的过程中需依次经过加成、取代、氧化、消去反应 | |
| D. | 此物质与氢气加成后的产物与此物质中氢原子的种类数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用手直接接触药品 | B. | 可用酒精灯对烧杯直接加热 | ||
| C. | 用鼻孔凑到容器口去闻气体的气味 | D. | 尝一下实验室里酒精的味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
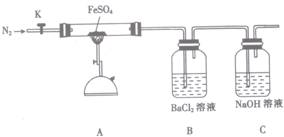
| 操作步骤 | 实验现象 | 用化学方程式解释原因 |
| 打开K,通入一段时间的N2,关闭活塞K,加热A中的玻璃管一段时间 | 洗气瓶B中①有白色沉淀生成 | ②SO3+H2O+BaCl2=BaSO4↓+2HCl |
| A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却 | 硬质玻璃管中最终可以看到③有红棕色固体物质生成 | ④2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑ |
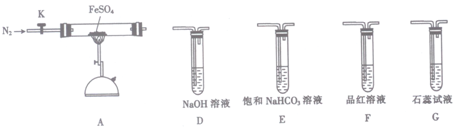
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: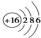 | |
| D. | 丙醛的结构简式:CH3CH2COH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
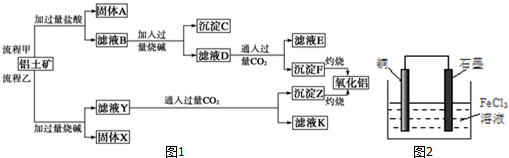
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com