
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
分析 2min后达到平衡时,A的转化率为50%,2min内A的平均反应速率=$\frac{\frac{2mol×50%}{2L}}{2min}$=0.25mol/(L•min),
A.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比;
B.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,据此计算x值;
C.A的转化率为50%时,A参加反应的物质的量=2mol×50%=1mol,根据方程式知,参加反应的B的物质的量=$\frac{3}{2}$×1mol=1.5mol,B的转化率=$\frac{1.5mol}{2mol}×100%$;
D.x=2,根据方程式知,生成D的物质的量=0.25mol/(L•min)×2L×2min=1mol,生成C、D的物质的量相等为1mol,所以反应平衡时混合物的总物质的量=2mol+2mol-1mol-1.5mol+1mol+1mol=3.5mol,同一容器中,气体的物质的量之比等于其体积之比.
解答 解:2min后达到平衡时,A的转化率为50%,2min内A的平均反应速率=$\frac{\frac{2mol×50%}{2L}}{2min}$=0.25mol/(L•min),
A.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,所以v(A)=v(C)=0.25mol/(L•min),故A错误;
B.同一可逆反应中,同一时间段内各物质的反应速率之比等于其计量数之比,D的反应速率与A相等,所以x=2,故B错误;
C.A的转化率为50%时,A参加反应的物质的量=2mol×50%=1mol,根据方程式知,参加反应的B的物质的量=$\frac{3}{2}$×1mol=1.5mol,B的转化率=$\frac{1.5mol}{2mol}×100%$=75%,故C错误;
D.x=4,根据方程式知,生成D的物质的量=0.25mol/(L•min)×2L×2min=1mol,生成C、D的物质的量为1mol,所以反应平衡时混合物的总物质的量=2mol+2mol-1mol-1.5mol+1mol+1mol=3.5mol,同一容器中,气体的物质的量之比等于其体积之比,则C的体积分数=$\frac{1mol}{3.5mol}×100%$=28.6%,故D正确;
故选D.
点评 本题考查化学平衡计算,侧重考查分析计算能力,涉及转化率、体积分数、化学反应速率等基本计算,明确各有关公式含义即可解答,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ) | |
| B. | 用硅制作的太阳能电池是将化学能转化为电能 | |
| C. | 增加Zn(g)的量,△H2变大 | |
| D. | 以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2的酯有4种结构 | B. | 异丁烷的一氯代物有2种 | ||
| C. | 甲苯的一氯代物有4种 | D. | 纤维素在人体内可水解成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
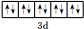
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
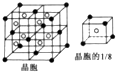
.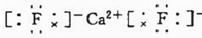 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池是通过燃烧方式将化学能转换为电能 | |
| B. | 氢氧燃料电池中,通入氢气的一极为正极 | |
| C. | 氢氧燃料电池是一种环境友好电池 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 该分散系能产生丁达尔效应 | |
| D. | 所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com