
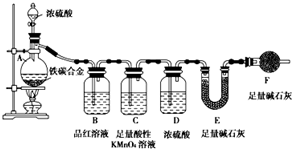
 现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置分析 (1)常温下铁在浓硫酸中钝化,常温下碳不与浓硫酸反应;
(2)铁与浓硫酸在加热条件下才能反应生成硫酸铁和二氧化硫;
(3)二氧化硫通入氯水和氯化钡溶液中,由于二氧化硫被氯气氧化成硫酸根离子,与钡离子能产生成硫酸钡沉淀,二氧化硫通入氨水和氯化钡溶液具有漂白性,二氧化硫和氨水生成亚硫酸铵,亚硫酸铵与氯化钡生成亚硫酸钡沉淀;
(4)装置F盛有碱石灰,可以吸收空气中的水蒸气和CO2;
(5)根据氧化还原反应分析计算.
解答 解:铁和碳单质均可以和浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫的检验可以用品红,吸收可以用高猛酸钾,将产生的二氧化碳用浓硫酸干燥,通入碱石灰,根据碱石灰增加的质量可以确定二氧化碳的质量,根据C元素守恒,可以计算碳单质的质量,进而计算碳的质量分数,
(1)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(2)点燃酒精灯一段时间后,A中剧烈反应,Fe与浓硫酸反应,化学方程式为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
(3)二氧化硫通入氯水和氯化钡溶液中,由于二氧化硫被氯气氧化成硫酸根离子,与钡离子能产生成硫酸钡沉淀,二氧化硫通入氨水和氯化钡溶液具有漂白性,二氧化硫和氨水生成亚硫酸铵,亚硫酸铵与氯化钡生成亚硫酸钡沉淀,所以都有白色沉淀,
故答案为:BaSO4;BaSO3;
(4)装置F防止外界空气中CO2、水蒸气进入E管,造成误差,
故答案为:防止空气中的水蒸气和CO2进入E,减少实验误差;
(5)SO2气体通入含有n mol Na2S的溶液中,溶液中出现黄色浑浊,根据溶液最多能吸收SO2,生成NaHSO3和S;
发生反应:5SO2+2Na2S+2H2O=3S↓+4NaHSO3
5 2
2.5nmol nmol
故答案为:2.5n.
点评 本题考查了物质性质的探究实验方法,装置的特征分析,流程反应和试剂作用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③④ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 惰性电极A为阳极,惰性电极B为阴极 | |
| B. | 电解过程中Li+向A电极迁移 | |
| C. | 阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | B极区电解液为LiOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序r(X)>r(Y)>r(Z)>r(R)>r(W) | |
| B. | 氢气在R的单质中燃烧火焰呈蓝色 | |
| C. | 元素X的氢化物的稳定性比Y的弱 | |
| D. | Y与Z形成的两种化合物中的化学键类型均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取钢化玻璃的原料为石灰石、纯碱和石英 | |
| B. | 钢化玻璃是一种新型无机非金属材料 | |
| C. | 制取钢化玻璃的主要反应都是非氧化还原反应 | |
| D. | 在碳素钢中加入镍等合金元素可以制得不锈钢及各种特种钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性F->Cl->S2- | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 乙烯比例模型  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 二甲醚汽车发动机具有显著的节能减排效果,其核心为燃料电池,该电池工作的原理示意图如图所示.下列有关说法错误的是( )
二甲醚汽车发动机具有显著的节能减排效果,其核心为燃料电池,该电池工作的原理示意图如图所示.下列有关说法错误的是( )| A. | 负极上的电极反应式CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| B. | 工作过程中,H+移向正极 | |
| C. | 每消耗0.5molO2就有2mole-通过离子交换膜 | |
| D. | 电池总反应为2C2H6O═4CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com