
����Ŀ��ʵ������NH4HCO3��NaHSO3�ĸ����״����ij��ѧ��ȤС��ⶨ����NH4HCO3�ĺ�����С���ͬѧ������ڻ�����м����ʵ�鷽�����ⶨ����NH4HCO3��������������SO2������KMnO4�ķ�Ӧԭ����SO2��MnO4����H����SO42����Mn2����H2O���ش��������⣺
��1����ѧС��Ҫ��ѡ��������ҩƷ����������ʵ�飨ͼ��ÿ������װ��ֻѡ����һ�Σ�����̨�ȹ̶�����δ������
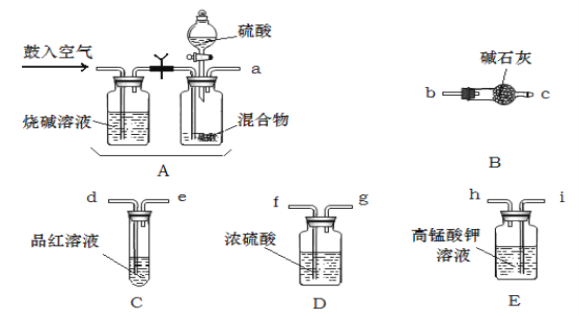
�밴�����������ҵķ���,��������˳���ǡ��������Ľӿ���ĸa��b...)a��_______f��g��_______��
��2��ʵ�鿪ʼ����������ǰ��Aװ����Ҫ��������������ǣ������Aװ���ٴι��������������_______��
��3��Eװ�õ������ǣ�_______��
��4��ʵ���У�����C�Թ�����Һ��ɫ����ô�ⶨ������ܻ�ƫ_______��Ϊ��ȷ��ʵ����C�Թ�����Һ����ɫ������ȡ��Ʒ������Ϊmg��ʵ��ǰE����װamol��L��1��KMnO4��Һ�����V��Ӧ����______mL��
��5������������Ʒ����Ϊ9.875g,������ú��ʯ������4.4g����ô�������NH4HCO3����������Ϊ_______��
��6���Ӷ����ⶨ��ȷ�ԵĽǶȿ��ǣ�����װ�û�Ӧ����һ���ĸĽ����Ľ��Ĵ�ʩ��_______��
���𰸡�i-h-d-e b-c �ų�װ���е�ԭ�п����������ɵ�����ȫ���������װ�û�ʹ��Ӧ���ɵ�SO2��CO2�ܱ���ȫ���� ��ȥSO2����ֹ�Բⶨ������� �� ![]() 80�� B֮���һ����ֹ������ˮ��CO2����B��װ��
80�� B֮���һ����ֹ������ˮ��CO2����B��װ��
��������
����ʵ��Ŀ�ļ����ʵ����ʷ���ʵ��װ�õ�����˳����ʵ��ԭ������ʵ�������ע���������������ԭ��Ӧ�е���ת���غ������ؼ��㡣
(1)����ʵ��ԭ�����������м������������̼�Ͷ����������壬�ø��������Һ��ȥ��������Ȼ��ͨ��Ʒ����Һ������������Ƿ���������Ž�����ͨ��Ũ����������ü�ʯ�����ն�����̼���壬��ʯ�����ӵ�������Ϊ������̼���������������װ������˳����a-i-h-d-e-f-g-b-c���ʴ�Ϊ�� i-h-d-e��b-c��
(2)ʵ�鿪ʼ����������ǰ��Aװ����Ҫ�������Ŀ�����ų�ϵͳ�еĶ�����̼���壬������ٴι��������������ʹ���ɵ�����ȫ���������װ�ã��ʴ�Ϊ���ų�װ����ԭ�п����������ɵ�����ȫ���������װ�ã�
(3)���������Һ�����������ն����������壬��ֹ��������Բⶨ�����Ӱ�죬�ʴ�Ϊ�����ն����������壬��ֹ��������Բⶨ�����Ӱ�죻
(4)��Ʒ����Һ��ɫ��˵��������������û�г�����������ʯ�����գ����Լ�ʯ��������ƫ����ʵ��ԭ��������֪������̼���������ƫ����������NH4HCO3ƫ�ⶨ�����ƫ�ߣ�Ϊ�˱�֤���������ܱ�ȫ�����գ����Լٶ�mg��Ʒȫ��NaHSO3���м��㣬�����ԭ���غ���Ʒ�в���������������ʵ���Ϊ![]() �����ݶ��������������ط�Ӧ����ʽ�ɵ�5SO2~2MnO4������
�����ݶ��������������ط�Ӧ����ʽ�ɵ�5SO2~2MnO4������![]() ��V=
��V=![]() mL ���ʴ�Ϊ���ߣ�
mL ���ʴ�Ϊ���ߣ�![]() ��
��
(5)��ʯ������4.4g����������̼���ʵ���Ϊ0.1mol����̼Ԫ���غ㣬̼��������ʵ���ҲΪ0.1mol��̼���������Ϊ7.9g��NH4HCO3����������Ϊ7.9g/9.875g��100%=80%���ʴ�Ϊ��80%��
(6)�Ӹ�װ�ò��������ʼ���װ�ýṹ�������Ӷ����ⶨ��ȷ�ԵĽǶȿ��ǣ�����װ�û�Ӧ����һ���ĸĽ����Ľ��Ĵ�ʩ��B֮���һ����ֹ������ˮ��CO2����B��װ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����������;

�����������������
A.NH4NO3�dz��û���
B.�����Ṥҵ�е�Ԫ�صĻ��ϼ۱仯�������3����2����4����5
C.NH3��NO2��һ�������·���������ԭ��Ӧ���仯ѧ����ʽ��8NH3��6NO2![]() 7N2��12H2O
7N2��12H2O
D.NH3�ڵ��ʹ�ҵ�е�Ԫ�ر���ԭ���������Ṥҵ�е�Ԫ�ر�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·������ͼ��ʾ��
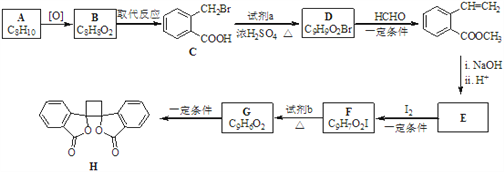
��֪��i.RCH2Br ![]() R��HC�TCH��R��
R��HC�TCH��R��
ii��R��HC�TCH��R��![]()
![]()
iii��R��HC�TCH��R��![]()
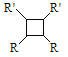
(����R��R'��R'�����⡢�������)
(1)A���ڷ���������������_______________________��
(2)D�Ľṹ��ʽ��_______________________________��
(3)��F����G�ķ�Ӧ������________________________________________��
(4)��E��I2��һ�������·�Ӧ����F�Ļ�ѧ����ʽ��_____________________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_______________________________��
(5)����˵����ȷ����___________(ѡ����ĸ���)��
A. G����˳���칹��
B. ��G����H�ķ�Ӧ�Ǽӳɷ�Ӧ
C. 1 mol G��������1 mol H2�����ӳɷ�Ӧ
D. 1 mol F��1 mol H������NaOH��Һ��Ӧ��������2 molNaOH
(6)����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳ�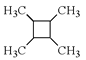 д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��___________________
д���ϳ�·��(�ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ����)��___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������������˵������·�Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ2��1���ǣ� ��
A. ![]()
B. Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
C. CaH2+2H2O===Ca��OH��2+2H2��
D. 3NO2+H2O===2HNO3+NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����CO2ͨ��ijŨ�ȵ�NaOH��Һ����ҺA����A��Һ����ε���ϡ���ᣬ����n(HCl)������n(CO2)�Ĺ�ϵ��ͼ�������йر�����ȷ��ѡ����
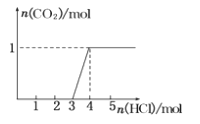
A.ͨ���CO2�����ڱ�״���µ���22.4L
B.��Һ��n(NaOH)��2n(Na2CO3)
C.A��Һ�мȺ�Na2CO3���ֺ�NaHCO3
D.A��Һ��һ��ֻ��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 =a kJ mol -1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 =bkJ mol-1
���ܶ��壺�ڱ�״���£���1 mol��̬����AB(g)����Ϊ��̬ԭ��
A(g)��B(g)�������������֪1 mol�����ļ���ΪxkJ�������������� ����ʾ������˵����ȷ����
��ѧ�� | C��O | C��H | O��H |
����/(kJ mol-1) | 798 | 413 | 463 |
A.������x=![]()
B.H2O(g) = H2O(1)����S<0����H=(a �� b) kJ mol -1
C.����4NA��O��H������ʱ����Ӧ�ų�������Ϊa kJ
D.���÷�Ӧ����Ƶ�ԭ��ص�⾫��ͭ�����������0.2NA������ʱ. �����ϵ��۵�������������6.4 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
��1�������������������С��ȵ���Ƭ��ͭƬͬʱ����ϡ����(��ϡ����)�У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԡ���ԭ�������ӷ���ʽΪ___��
��2����������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԡ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ����д�������ĵ缫��Ӧʽ___��

��3�������������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽��������(�뷽��������ͬ)��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q�Ƕ�����ԭ�������������������Ԫ�ء�X���γɻ�������������Ԫ�أ�Y��Z�γɵĻ������������ɸ���Σ��.������0. 01 mol/L��W������������ˮ�������Һ��pH=12��QԪ���γɵĵ����ڳ������ǻ���ɫ���塣
��1��д��YԪ���γɵĵ��ʵĵ���ʽ: _______________ .
��2��Z��W��Q����Ԫ�طֱ��Ӧ�ļ����Ӱ뾶��С����___________(�����ӷ���)��
��3��QZ2��һ�ֳȻ�ɫ���ױ����壬������й©�ͱ�ը�¹ʣ��������뱬ը�ֳ�ʱ�����ý���һ��Ũ�ȵ�ij�����ʵ�ˮ��Һ��ë����ס���ӣ� �����˲��õ�������_______ (����ĸ����)��
A. NaOH B. NaCl C. KC1 D. Na2CO3
��4��X��Y��W����Ԫ�ؿ����γ�һ���о綾���Σ���QZ2���Գ�ȥˮ��Һ�к��еĸ��ж����ʣ��õ�һ�������г����Ĺ��������������. д���÷�Ӧ�����ӷ���ʽ:__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(H3PO4)����Һ���ܹ���H3PO4��H2PO4����HPO42������PO43������������ʽ���ڣ�����Һ��pH�����仯ʱ��������һ�����ӵ����ʵ���ռ�������������ʵ����ķ�����Ҳ���ܷ����仯����ͼ��H3PO4��Һ�У��������ӵ����ʵ�����������pH�ı仯���ߣ�

(1)��Na3PO4��Һ����ε���ϡ���ᣬ��pH��9����6�Ĺ����з�������Ҫ��Ӧ�����ӷ���ʽΪ________����pH��7ʱ����Һ����Ҫ���ڵ�������(OH�����ӳ���)��__________��
(2)��ͼ���ƶ�NaH2PO4��Һ��______��(��ᡱ������С�)����ԭ����_________��
(3)��Na3PO4��Һ�У�c(Na+)/c(PO43-)______3(���������������)�������Һ�е��뼸��ŨKOH��Һ��c(Na+)/c(PO43-)��ֵ��С��ԭ����____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com