

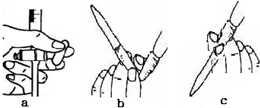
分析 (1)根据配制溶液的操作步骤判断所用仪器;
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)根据硝酸具有酸性,能使紫色石蕊试液变红判断;没有观察到现象说明溶液不呈酸性,则生成的硝酸与碱发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,据此分析观察到的现象;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b.
解答 解:(1)量取浓氨水要用量筒,稀释浓氨水要用烧杯、玻璃棒,配制溶液要用100mL容量瓶,胶头滴管,故答案为:胶头滴管;
(2)甲装置不需要加热即能同时产生氨气和氧气,说明固体X溶于氨水即放热又产生氧气,则该固体为过氧化钠,故答案为:过氧化钠;
(3)乙装置为干燥管,作用是干燥氧气和氨气的混合气体;丙装置发生反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:干燥氧气和氨气的混合气体; 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)因为硝酸具有酸性,能使紫色石蕊试液变红,所以当戊中观察到紫色石蕊试液变红,说明已制得硝酸;没有观察到现象说明溶液不呈酸性,则生成的硝酸与过量的氨气发生了反应;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶除去多余的氨气确保戊溶液呈酸性,
故答案为:紫色石蕊试液变红;过量的氨气致使戊中溶液不一定呈酸性;在丙和丁之间连接盛有无水氯化钙的干燥管或盛有浓硫酸的洗气瓶;
(5)改进后待反应结束,将丁装置收集的为二氧化氮,倒立在盛水的水槽中,二氧化氮与水反应生成一氧化氮和硝酸,所以观察到的现象为烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;滴定前发现滴定管尖嘴处有少量气泡,请选择排出气泡的正确操作是b,
故答案为:烧瓶内水面慢慢上升,上升到一定高度不再变化,试管内气体颜色由红棕色逐渐变淡至无色;b.
点评 本题考查了实验室制氨气的原理和装置以及探究硝酸的制备和性质,同时考查了浓硫酸、氨气等物质的性质应用,难度一般.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| B. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| C. | SiO2是酸性氧化物,能和碱反应,不能和酸反应 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
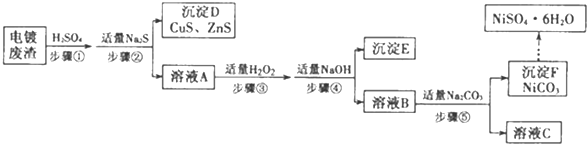
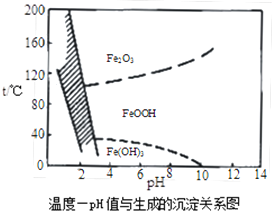
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)正=2v(CO2)逆 | B. | 密闭容器中总压强不变 | ||
| C. | 密闭容器中氨气的体积分数不变 | D. | 密闭容器中混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 电路中每转移12mol电子,最多有1molCr2O${\;}_{7}^{2-}$被还原 | |
| C. | 过程中有Fe(OH)3沉淀生成 | |
| D. | 电解过程中溶液pH不会变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
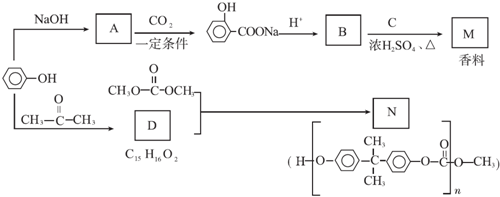
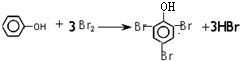 .
. ;
; +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$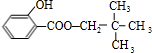 +H2O.
+H2O.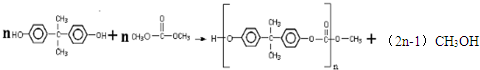 ,反应类型为缩聚反应.
,反应类型为缩聚反应.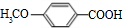 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
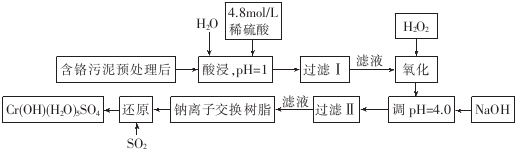
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0 溶解) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com