
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
分析 A、由反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,混合气体中NO与O2的体积之比为2:1;
B、因为4NO2+O2+2H2O=4HNO3,而所以氧气有剩余,NO2与O2的混合气体为a L,所以NO2的体积为:$\frac{2}{3}a$,消耗氧气为:$\frac{\frac{2}{3}a}{4}$=$\frac{1}{6}a$;
C、状况不知,气体体积不知,所以不能由气体的体积求物质的量;
D、反应后溶液的体积不知.
解答 解:A、由反应2AgNO3 $\frac{\underline{\;\;△\;\;}}{\;}$ 2Ag+2NO2↑+O2↑可知,混合气体中NO与O2的体积之比为2:1,而不是4:1,故A错误;
B、因为4NO2+O2+2H2O=4HNO3,而所以氧气有剩余,NO2与O2的混合气体为a L,所以NO2的体积为:$\frac{2}{3}a$,消耗氧气为:$\frac{\frac{2}{3}a}{4}$=$\frac{1}{6}a$,所以c=$\frac{1}{3}a$-$\frac{1}{6}a$=$\frac{a}{6}$,故B正确;
C、状况不知,气体体积不知,所以不能由气体的体积求物质的量,故C错误;
D、反应后溶液的体积不知,所以无法应用公式c=$\frac{n}{V}$,故D错误;
故选B.
点评 本题考查混合物的计算,侧重考查分析计算能力,明确二氧化氮和水反应中二氧化氮、氧气的比例关系是解本题关键,注意结合原子守恒解答问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量增重了 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
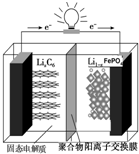 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取LKSCN溶液,向试管中滴入1~2滴0.1mol/LKSCN溶液 | (1)若出现红色,则假设1成立; (2)若未出现红色,则假设2或假设3成立. |
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液 | 1若品红溶液红色褪色,假设2成立; 2若品红溶液不褪色,结合步骤1中的(2)则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O 的质量是18 g/mol | |
| B. | CH4 的摩尔质量是16 g | |
| C. | 标准状况下,1 mol 任何物质的体积均为22.4 L | |
| D. | 3.01×1023个O2分子的质量是16 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com