
分析 (1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
(2)根据①书写氢气燃烧生成水的热化学方程式,再根据n=$\frac{m}{M}$计算出燃烧10g H2的物质的量,结合热化学方程式计算放出的热量;
(3)化学计量数与反应热成正比,根据④⑤构建CO燃烧的热化学方程式,根据热化学方程式的书写方法书写来解答.
解答 解:(1)⑤C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,1mol碳燃烧生成稳定的二氧化碳气体,符合燃烧热的概念要求,放出的热量393.5KJ为燃烧热,即C的燃烧热为393.5KJ/mol,
故答案为:393.5KJ/mol;
(2)①H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ/mol
根据①得:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,10g H2的物质的量n=$\frac{m}{M}$=$\frac{10g}{2g/mol}$=5mol,放出的热量为5mol×285.8kJ/mol=1429KJ,
故答案为:1429KJ;
(3)④C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
⑤C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,⑤-④得CO燃烧的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol.
点评 本题主要考查了燃烧热、热化学方程式的书写,为高频考点,侧重考查学生的分析、计算能力,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,注意理解燃烧热的定义,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 有强氧化性 | |
| B. | 1mol三甲基硼所含共价键数目为12NA | |
| C. | 与HBr发生加成反应 | |
| D. | 5.6g三甲基硼的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
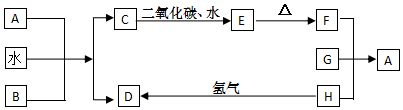
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①④⑤⑥ | C. | ②③④⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将该反应设计成原电池,反应时化学能转化为电能 | |
| B. | △H的值与反应方程式的化学计量数有关 | |
| C. | 若将该反应设计成原电池,铁棒为负极 | |
| D. | 若将其设计为原电池,当有28gFe溶解时,正极放出气体的体积11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
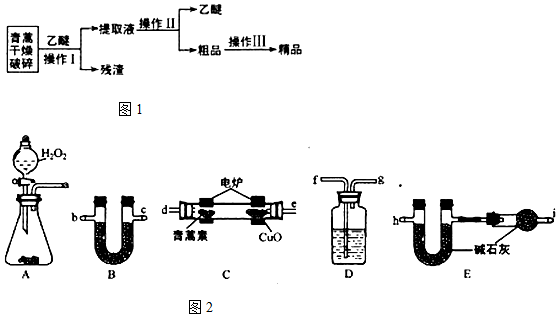
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4、CuO | B. | C、CuO | C. | Fe、MnO2 | D. | Si、FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com