
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1mol X��1mol Y���з�Ӧ��2X��g��+Y��g��Z��g������60s�ﵽƽ�⣬����0.3mol Z������˵����ȷ���ǣ� ��
A.������ѹǿ��������Y��ת���ʼ�С
B.�����������Ϊ5 L��Z��ƽ��Ũ�ȱ�Ϊԭ����2��
C.YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.0005 mol/��Ls ��
D.�������¶ȣ�X���������������÷�Ӧ�ġ�H��0
���𰸡�C
���������⣺A���÷�ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���������Y��ת��������A���� B�������Сһ�룬��ƽ�ⲻ�ƶ���Z��Ũ��Ϊԭ����2����������ѹǿƽ�������ƶ�����Z��ƽ��Ũ�ȱ����ԭ����2������B����
C��YŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ ![]() =0.0005 mol/��Ls ������C��ȷ��
=0.0005 mol/��Ls ������C��ȷ��
D���������¶ȣ�X�������������֪�����¶ȣ�ƽ�������ƶ�����÷�Ӧ�ġ�H��0����D����
��ѡC��
��60s�ﵽƽ�⣬����0.3mol Z����
2X��g��+ | Y��g�� | Z��g�� | |
��ʼ | 1 | 1 | 0 |
ת�� | 0.6 | 0.3 | 0.3 |
ƽ�� | 0.4 | 0.7 | 0.3 |
A���÷�ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ���
B�������Сһ�룬��ƽ�ⲻ�ƶ���Z��Ũ��Ϊԭ����2����������ѹǿƽ�������ƶ���
C�����v= ![]() ���㣻
���㣻
D���������¶ȣ�X�������������֪�����¶ȣ�ƽ�������ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ���ǣ� ��
A.���³�ѹ�£�1mol���鹲�õ��Ӷ���Ϊ10 NA
B.0.5 mol�����0.5 mol������ȫȼ�����ĵ�O2��������Ϊ0.2NA
C.��״���£�1L������ȼ�պ�������̬����ķ�����Ϊ ![]() NA
NA
D.1 mol�״��������Ʒ�Ӧ��ת�Ƶ�����ĿΪ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ϩ��������KMnO4��Һ��˫��������ʽΪ�� 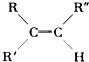
![]()
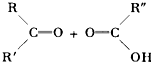 ���ж�ϩ��C10H18������KMnO4��Һ���ú�ɵõ������л����CH3��2CO��CH3COOH��CH3CO��CH2��2��COOH���ɴ��ƶϴ˶�ϩ���ܵĽṹ��ʽΪ�� ��
���ж�ϩ��C10H18������KMnO4��Һ���ú�ɵõ������л����CH3��2CO��CH3COOH��CH3CO��CH2��2��COOH���ɴ��ƶϴ˶�ϩ���ܵĽṹ��ʽΪ�� ��
A.��CH3��2C�TC��CH3��CH2CH2CH�TCH CH2CH3
B.��CH3��2C�TCHCH2CH2C��CH3���TCHCH3
C.CH3CH�TC��CH3��CH2CH2CH2C��CH3���TCH2
D.CH3CH�TC��CH3��CH2CH2CH2CH�TCHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�����û������Ʊ�����ϩ���������������£���Ӧԭ���� 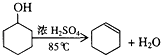 ��Ӧ���������������ʣ�
��Ӧ���������������ʣ�
�ܶȣ�g/cm3�� | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
��1��ʵ������п��ܷ������л�����Ӧ�ķ���ʽΪ ��
��2�������������ϣ�װ�ã�A��B��C��������������ɱ����Ʊ�ʵ�飮 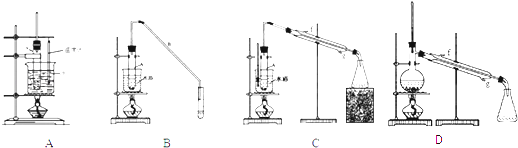
��3���Ʊ��ֲ�Ʒ ��5mL�����Թ�A�У��ټ���10m �� ҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ��
��4���ֲ�Ʒ�ᴿ �ٻ���ϩ�ֲ�Ʒ�к��л������������������ʵȣ��ֲ�Ʒ�����ξ���ˮϴ����̼������Һϴ���Լ��ڶ���ˮϴ���ڴ˹����м���̼������Һ��Ŀ��������Һʱ������ϩӦ�ӷ�Һ©��������ϡ����¡�����ȡ����
����ˮϴ��Ļ���ϩ�м�����������ˮ�Ȼ��ƣ��ٽ���������ͼD��ʾװ�õ������������ƣ��У����������ռ���Ʒʱ���¶ȼ���ʾ���¶�ӦΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��������4�����ӵĽṹʾ��ͼ��
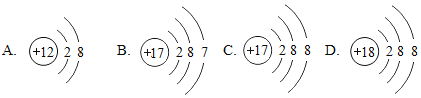
ͼ�����ӹ��ܱ�ʾ_______��Ԫ�أ�ͼ�б�ʾ����������____________�������ӷ��ű�ʾ����ͼ��A����ʾ��Ԫ����Ԫ�����ڱ��е�λ��_____________________________��
��2����1-18�ŵĶ���������Ԫ���У����е���ĸ����һ��Ԫ�أ��ش��������⣺
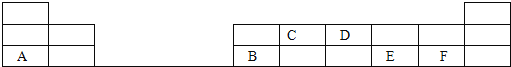
��д��D���ʵĵ���ʽ_____________________��
��д��C�����������Ľṹʽ_____________________��
��E��F�ֱ��γɵ���̬�⻯���н��ȶ����ǣ���д�⻯��Ļ�ѧʽ��_____________________��
��A����������ˮ����������ѧ��Ϊ___________________���侧������Ϊ________����ˮ��Һ��B��Ӧ�����ӷ���ʽΪ___________________________��
��3��X��Y��Z��M��N��Q��Ϊ����������Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ��ͼ��ʾ������˵����ȷ���� ��______��

A�������ԣ�N��Q B������������Ӧˮ�������ԣ�M��Y��N
C�������Ӱ뾶��Q��N��X D��ԭ��������Z��M��X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к��Ȳⶨʵ���У���50mL0.50mol/L�����50mL0.55mol/LNaOH��Һ����ʵ�飬����˵������ȷ���ǣ� �� 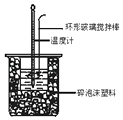
A.����25mL 0.50mol/L�����25mL 0.55 mol/L NaOH��Һ���з�Ӧ��������к�����ֵ��ԭ����ͬ
B.�����ʱ����Ͳ��NaOH��ҺӦ��������С�ձ��У������ò���������
C.װ���еĴ�С�ձ�֮����������ĭ���ϵ������DZ��¸��ȼ���������ʧ
D.ʵ����Ӧ��¼������������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�����ܺ���Al3+��Ba2+��NH ![]() ��Fe2+��Fe3+��CO
��Fe2+��Fe3+��CO ![]() ��SO
��SO ![]() ��SiO
��SiO ![]() ��NO
��NO ![]() �е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת����ͼ����Ӧ��������һ�������Ǻ���ɫ�� ��ش��������⣺
�е�һ�ֻ������ӣ�ȡ����Һ����ʵ�飬������ת����ͼ����Ӧ��������һ�������Ǻ���ɫ�� ��ش��������⣺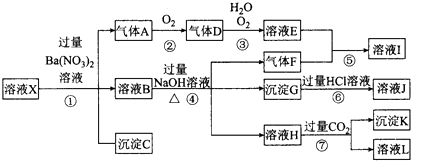
��1����ǿ�������������ж���ҺX��һ�������ڵ������� ��
��2����ҺX�У�����N03�����ж�һ����ȷ���� �� a��һ���� b��һ��û�� c��������
��3����������A�����ӷ���ʽΪ ��
��4��ת��������Ӧ������Ϊ ��
��5��ת�����в���H�����ӷ���ʽΪ ��
��6����ת�����У�D��H2O��O2��������ǡ�÷������Ϸ�Ӧ����E����Ӧ��D��O2�����ʵ���֮��Ϊ
��7���Բ���ȷ���Ƿ���ڵ����ӣ�������ȡX��Һ������������Һ�е�һ�֣����������жϣ����Լ������ ��NaOH��Һ����KSCN��Һ����ʯ���Լ�����pH��ֽ����KMnO4��Һ������ˮ��KSCN�Ļ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.02molL��1MOH��Һ�ζ�100mL0.01molL��1HA��Һ����ͼΪ����MOH��Һ�����������Һ��pH�仯�������Һ����仯���Բ��ƣ����ش��������⣺ 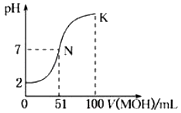
��1����ͼ����Ϣ��֪HAΪ�ᣨ�ǿ�������������ζ����õ�������ָʾ��Ϊ �� �ζ�ʱ�۾�ע�� ��
��2��������һ��Ũ�ȵ�MAϡ��Һ��pH=a����a7������ڡ�����С�ڡ����ڡ�����ʱ����Һ��ˮ�������c��OH����=mol/L��
��3����д��K������Ӧ����Һ������Ũ�ȵ��ɴ�С�Ĺ�ϵ�� ��
��4��K������Ӧ����Һ�У�c��M+��+c��MOH��2c��A������������ڡ���С�ڡ������ڡ���
��5��������MOH��Һ��ˮϡ�����У�������ֵ��С����������ţ� ��c��H+�� �� ![]() ��c��OH���� ��
��c��OH���� �� ![]() ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com