
 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究。回答下列问题:
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了Cl元素的非金属性比Br强的实验研究。回答下列问题:
(1)图中E装置名称是_____________。
(2) N、C、Si的非金属性由强到弱的顺序是:_____________;
从以下所给物质中选出甲同学设计的实验所用到物
质:试剂A为_______;试剂C为_________(填序号)。
①稀HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液
⑤SiO2
(3) 乙同学设计的实验中(酒精灯加热装置在图中未画出),若试
剂C为溴化钾溶液溶液外,还需要用到的试剂有:试剂A为
________;试剂B为 ________。[Z§X§
科目:高中化学 来源: 题型:
已知有机物A~I之间的转化关系如下图所示:
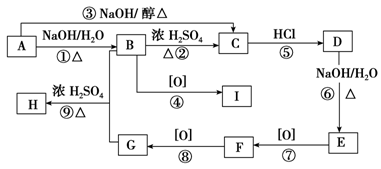
已知:
①A与D、B与E、I与F互为同分异构体
②将新制Cu(OH)2悬浊液分别加入到有机物I、F中,加热,I无明显现象,F反应并生成砖红色物质
③C的实验式与乙炔相同,且相对分子质量为104
④E的一种同分异构体与FeCl3能发生显色反应
根据以上信息,回答下列问题:
(1)H、 F中含有的含氧官能团名称分别为 、 。
(2)反应①~⑨中属于消去反应的是____________________________。
(3)I的结构简式为____________________________。
(4)写出H在酸性条件下水解的化学方程式 。
(5)写出F与银氨溶液反应的化学方程式 。
(6)符合以下条件的G的同分异构体有________种;其中苯环上只有2种一元取代物的结构简式为 。
①属于芳香族化合物
②能与NaOH溶液反应
③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为CH4+10OH—-8e- CO32—+7H2O,下列叙述正确的是
CO32—+7H2O,下列叙述正确的是
A.通入甲烷的一极为正极 B.通入氧气的一极发生氧化反应
C.该电池在工作时,溶液中的阴离子向正极移动
D.该电池总反应为CH4+2O2+2OH— CO32— +3H2O
CO32— +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物6.2 g在氧气中完全燃烧,只生成8.8 g CO2和5.4 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素 B. 该化合物中碳、氢原子个数比为1:4
C. 无法确定该化合物是否含有氧元素 D. 该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用硫酸铝与硫黄焙烧制备氧化铝:2Al2(SO4)3+3S  2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
A.反应中Al2(SO4)3被氧化
B.Al2(SO4)3、Al2O3均含有离子键和共价键
C.5.1 g Al2O3含有9.03×1022个阴离子
D.该反应中,每转移0.3 mol电子生成5.04 L SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修2:化学与技术](15分)
某工业废水中含有CN-和Cr2O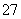 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O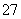 转移2.4 mol e-,该反应离子方程式为________。
转移2.4 mol e-,该反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式:________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:___________________________________________________(分解反应)。
(3)图131表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________________________________________________________________
________________________________________________________________________。
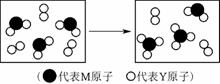
图131
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进 水的电离,则A的化学式为________,B的化学式为________。
水的电离,则A的化学式为________,B的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com