
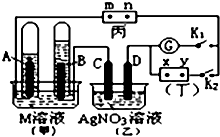
 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:分析 A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极;
(1)电解M的溶液实质上是电解水,结合选项分析;
(2)C与负极相连,为阴极,银离子得电子生成Ag;
(3)m与正极相连为阳极,碘离子失电子生成单质碘;
(4)闭合K2、断开K1一段时间后,断开K2、闭合K1,若M溶液为KOH溶液,甲中形成燃料电池,A上氢气失电子生成水;乙中为电解硝酸银溶液.
解答 解:A、B两极产生的气体体积之比为2:1,则A电极上生成氢气,B电极上生成氧气,所以A为阴极,B为阳极,x为正极,y为负极;
(1)电解KNO3溶液、Ba(OH)2溶液、H2SO4溶液实际上是电解水,电解氯化钠溶液是电解氯化钠和水,电解硫酸铜是电解铜离子和水,所以只有ABC符合;
故答案为:ABC;
(2)C与负极相连,为阴极,阴极上银离子得电子生成Ag,电极方程式为:Ag++e-=Ag;
故答案为:Ag++e-=Ag;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,所以m端滤纸变蓝;
故答案为:滤纸变蓝;
(4)闭合K2、断开K1一段时间后,断开K2、闭合K1,若M溶液为KOH溶液,甲中形成燃料电池,A上氢气失电子生成水,则A的电极反应为:H2+2OH--2e-═2H2O;乙中为电解硝酸银溶液,反应为4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4H+,所以溶液的pH减小;
故答案为:H2+2OH--2e-═2H2O;减小.
点评 本题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题,题目有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,注意根据电解现象判断阴阳极和正负极.


科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
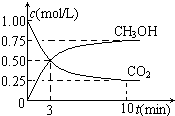 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
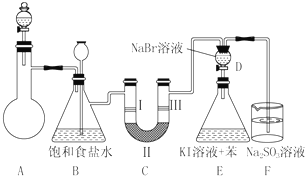
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用敞开放置久了的浓硫酸进行配制 | B. | 量取浓硫酸仰视刻度线 | ||
| C. | 配制过程中未洗涤烧杯和玻璃棒 | D. | 配制前,容量瓶有少许蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
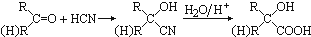 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: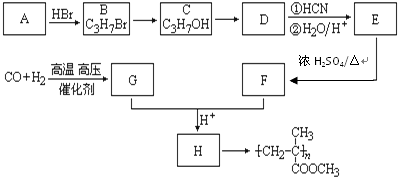
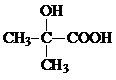 ;
; ;
;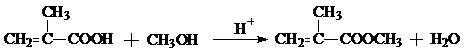 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com