
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
分析 A.甲烷分子结构为正四面体;
B.一氯甲烷在常温下呈气态;
C.乙烯与氯气发生加成反应生成1,2-二氯乙烷,乙烯与水发生加成反应生成乙醇;
D.CF3CHClBr对应的同分异构体中,可根据卤素原子的位置不同判断.
解答 解:A.甲烷分子结构为正四面体,CH2Cl2是2个氯原子取代甲烷中的2个氢原子,分子构型为四面体,故A错误;
B.一氯甲烷在常温下呈气态,二氯甲烷、三氯甲烷、四氯甲烷在常温下呈液态,故B错误;
C.乙烯与氯气反应生成1,2-二氯乙烷,乙烯与水反应生成乙醇,两者都是加成反应,故C错误;
D.CF3CHClBr对应的同分异构体中,可根据卤素原子的位置不同判断,如F不在同一个C原子上,存在的同分异构体有3种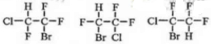 ,故D正确;
,故D正确;
故选D.
点评 本题综合考查卤代烃的组成、结构和性质,侧重于学生的分析能力的考查,注意把握同分异构体的判断,难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂pH=1 | B. | 食醋pH=3 | C. | 肥皂水pH=10 | D. | 厨房洗涤剂pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁生锈,负极反应式为:Fe-3e-=Fe3+ | |
| B. | 用石墨做电极电解硫酸铜溶液,有Cu和O2析出:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2O | |
| C. | Na2CO3溶液滴加酚酞,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 酸性高锰酸钾溶液中加入草酸钠,溶液褪色:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
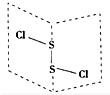 二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,下列说法中错误的是( )| A. | S2Cl2的电子式为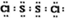 | |
| B. | 反应中SO2是还原产物,S是氧化产物 | |
| C. | S2Cl2为含有极性键和非极性键的极性分子 | |
| D. | 反应中,生成1molSO2,转移电子为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素,原子失电子能力越强,最高化合价越高 | |
| B. | 同主族的单核阴离子,其还原性越强,水解程度越大 | |
| C. | IA和VIIA族元素间可形成共价化合物 | |
| D. | 第二周期元素从左到右最高化合价从+1到+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
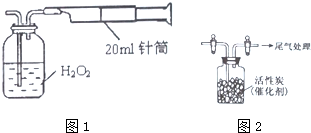 节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染.实验小组同学欲测定空气中SO2的含量,并探究SO2的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com