
实验室配制欲配制480mL4.0mol•L﹣1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
(1)配制该溶液应选用的玻璃仪器主要有:天平、量筒、烧杯、玻璃棒、 、 .
(2)用托盘天平称取 g固体NaOH.
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入蒸馏水,用玻璃棒搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
(4)用少量蒸馏水洗涤烧杯2﹣3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
(5)定容.滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.
(6)以下因素会造成实验结果偏低的是 (不一定是单选,多选漏选均不得分).
A.定容时观察液面仰视 B.定容时观察液面俯视
C.有少量NaOH溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水
(7)实验室中加热灼烧固体时,被加热的固体应盛在什么仪器中,写出该仪器的名称 .
(8)某同学用托盘天平称量的某石块的质量,读数如图所示,其读数的准确值是 g.

考点:
配制一定物质的量浓度的溶液.
专题:
实验题.
分析:
(1)没有480mL的容量瓶,应选择大于480mL且规格相近的500mL的容量瓶;根据配制一定物质的量浓度的溶液步骤选用仪器;
(2)根据m=nM=cVM计算出配制500mL 4.0mol•L﹣1的NaOH溶液,需要氢氧化钠固体的质量;
(6)根据c=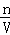 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(7)加热灼烧固体时,应该将固体盛放在坩埚中;
(8)根据托盘天平的称量原理计算出称量的石块的质量.
解答:
解:(1)实验室没有480mL的容量瓶,配制时需要选用500mL的容量瓶,配制500mL 4.0mol•L﹣1的NaOH溶液的操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2﹣3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,应选用的玻璃仪器主要有:天平、量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(2)配制500mL 4mol•L﹣1的NaOH溶液,溶质的物质的量为:4mol/L×0.5L=2mol,溶质的质量为:2mol×40g/mol=80g,
故答案为:80;
(6)A.定容时观察液面仰视,导致所配溶液的体积偏大,配制溶液的浓度偏低,故A正确;
B.定容时观察液面俯视,导致所配溶液的体积偏小,配制溶液的浓度偏高,故B错误;
C.有少量NaOH溶液残留在烧杯中,导致溶质的质量偏小,配制溶液的浓度偏低,故C正确;
D.容量瓶中原来有少量蒸馏水,对溶液的体积无影响,配制溶液的浓度不变,故D错误;
故选AC.
(7)实验室中加热灼烧固体时,被加热的固体应盛坩埚中,故答案为:坩埚;
(8)根据图示可知,砝码的质量为5g,游码的读数为2.0g,所以石块的质量为:5g+2.0g=7.0g,故答案为:7.0.
点评:
本题考查了配制一定物质的量浓度的溶液的方法、托盘天平的使用方法等知识,题目难度中等,试题基础性强,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
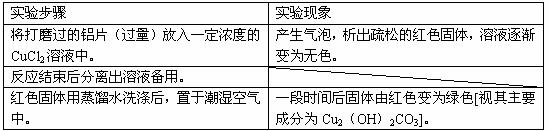
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________________________________;
化合反应____________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。
持续电解,在阴极附近的溶液中还可观察到的现象是__________________________ __________________________________。
解释此现象的离子方程式是________________________、_________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
____________________________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重金属离子具有毒性.实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙废液中可能含有的离子是( )
|
| A. | Cu2+和SO42﹣ | B. | Cu2+和Cl﹣ | C. | K+和SO42﹣ | D. | Ag+和NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列反应的化学方程式:①Zn+CuSO4=ZnSO4+Cu、②Cu+2AgNO3=Cu(NO3)2+2Ag,判断三种金属的还原性强弱顺序是( )
|
| A. | Zn>Cu>Ag | B. | Zn>Ag>Cu | C. | Cu>Ag>Zn | D. | Ag>Cu>Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤;
正确的操作顺序是( )
|
| A. | ③②①⑤④ | B. | ①②③⑤④ | C. | ②③①⑤④ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向平衡体系2NO+O2═2NO2中,通入18O组成的氧气,重新达到平衡后,18O存在于( )
|
| A. | 仅在O2中 | B. | 仅在NO2中 |
|
| C. | 仅在O2和NO2中 | D. | 平衡体系中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
|
| A. | 铜是还原剂,发生了氧化反应 |
|
| B. | 每生成1molSO2,转移电子的物质的量是2mol |
|
| C. | 每消耗1molCu,起氧化剂作用的硫酸消耗2mol |
|
| D. | 反应后物质中可能有白色固体出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com