
可以大量共存的离子组是
A.Na+、Fe2+、NO3-、C1- B.K+、HCO3-、SO42-、OH-
C.C1O-、C1-、Na+、H+ D.Ba2+、K+、SO42-、H+
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:填空题
(16分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式____;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)过氧化钠与干燥的二氧化碳不反应,与湿润的二氧化碳反应生成氧气,则该过程的两个反应方程式分别为___________________、__________________。
(4)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(5)向含1molFeBr2的溶液中通入______L(标准状况下)氯气,才能将Fe2+全部转化为Fe3+。(6)足量的铜与一定体积的浓硫酸反应,反应后溶液中所含的溶质有______(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:填空题
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;7在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三10月月考化学试卷(解析版) 题型:选择题
分类是化学学习与研究的常用方法,下列分类正确的是

A.Na2O2、MgO、Al2O3均属于碱性氧化物
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列现象或事实不能用同一原理解释的是
A.浓硝酸和氯水用棕色试剂瓶保存
B.硫化钠和亚硫酸钠固体长期暴露在空气中变质
C.常温下铁和铂都不溶于浓硝酸
D.SO2和Na2SO3溶液都能使氯水褪色
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列是关于氯水的叙述,正确的是
A.新制氯水中只含C12和HClO分子B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2D.氯水放置数天后,pH值将增大
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:实验题
(11分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
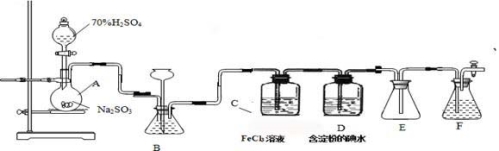
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____ ,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,
写出有关离子方程式:
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三11月阶段模块考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应: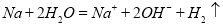
B.硅酸钠溶液与醋酸溶液混合: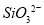 +
+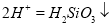
C.0.01mol/LNH4Al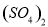 溶液与0.02mol/LBa(OH)2溶液等体积混合:
溶液与0.02mol/LBa(OH)2溶液等体积混合: 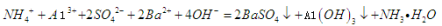
D.向次氯酸钙溶液通入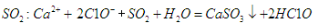
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高三10月份月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式正确的是
A.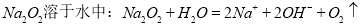
B.用FeC13溶液腐蚀电路板: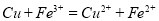
C.向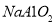 溶液中通入过量
溶液中通入过量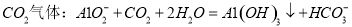
D. 用食醋除去水瓶中的水垢: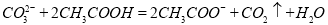
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com