
分析 (1)反应中Fe元素化合价升高,C元素化合价降低,计算生成C的物质的量,结合C元素化合价变价计算转移电子物质的量;
(2)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时,
CO2(g)+4H2 (g)?CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
代入K计算平衡常数,再根据平衡常数相对大小判断温度对平衡移动的影响.
解答 解:(1)①由方程式可知,每生成1mol Fe3O4时生成0.5molC,C元素化合价由+4价降低为0价,故转移电子为0.5mol×4=2mol,故答案为:2;
(2)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时,
CO2(g)+4H2 (g)?CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
则CO2的平衡转化率为$\frac{0.8}{1}$×100%=80%;平衡常数K=$\frac{0.8×1.{6}^{2}}{0.2×0.{8}^{4}}$=25,200℃时该反应的平衡常数K=64.8,大于300℃时该反应的平衡常数25,说明降低温度平衡向正反应方向移动,故正反应为放热反应,即Q<0,
故答案为:80%;25;<.
点评 本题考查平衡常数计算、氧化还原反应计算,注意对概念的理解掌握,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国科学家屠呦呦成功提取出青蒿素用于治疗疟疾,挽救许人的生命 | |
| B. | 法国的让彼埃尔索瓦等三位科学家成功研制出分子机器 | |
| C. | 美国的三位科学家在拓扑相变领域的突出贡献 | |
| D. | 中国科学家蔡启瑞院士非酶催化剂合成氨以及化学方面突碳一出贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中1 mol金属镁变成镁离子时失去电子的数目为2NA | |
| B. | 28 g氮气所含有的原子数目为NA | |
| C. | 标准状况下,22.4 L水中含有NA个水分子 | |
| D. | 标准状况下,22.4 L氯化氢所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡 时数 据 | 反应能量变化的绝对值(kJ) | a | b | c |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
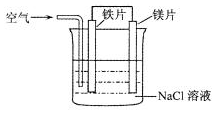
| A. | 镁片为负极,镁片上产生黄绿色气体 | |
| B. | 铁片为阳极,铁片上产生无色气体 | |
| C. | 溶液中铁片与镁片之间产生白色沉淀 | |
| D. | 溶液的pH将逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com